En las comunidades actuales del área andina el parentesco es bilateral; sin embargo, es muy posible que los sistemas de residencia varíen de acuerdo con factores sociales temporales y económicos, practicando un sistema matrilocal o patrilocal y, en otros casos, bilateral o neolocal como lo destaca Ortiz Rescaniere (Reference Ortiz Rescaniere1989). Tales convenciones garantizan la propiedad de la tierra, del ganado y de bienes materiales que facilitan la subsistencia de la pareja y de su descendencia y, en definitiva, sustentan la estabilidad de la población. Es interesante el comportamiento adaptativo relatado por Collins (Reference Collins1981) en los Aymara del sur de Perú, en donde se practica la residencia posmarital neolocal: las parejas jóvenes después del matrimonio residen con algunos de los padres hasta lograr los recursos necesarios para independizarse. En los Aymara del norte de Chile la residencia matrimonial actual es patrilocal (Carrasco Gutiérrez y Gavilán Vega Reference Carrasco Gutiérrez and Gavilán Vega2014; Dransart Reference Dransart, Albarella and Trentacoste2011). En los Chimane seminómades de los grupos Macro-Pano de Bolivia la residencia es matrilocal y neolocal y la herencia es patrilineal (Bert i Fibla Reference Bert i Fibla2005).
Sin embargo, en las poblaciones antiguas de la región es escaso el conocimiento sobre las relaciones sociales, el parentesco y las prácticas de residencia posmaritales cuyo origen y evolución puede ser establecido a partir de la investigación bioarqueológica. La información necesaria se puede obtener mediante la determinación de la variabilidad espacial de los fenotipos medios y de las pautas migratorias de los sexos entre localidades y regiones. A continuación, se presentan ejemplos de experiencias realizadas mediante el empleo de rasgos fenotípicos y genéticos obtenidos en restos esqueletales.
En la reserva Allegany Seneca del estado de Nueva York (1850–1930) se comprobó que se podía inferir el patrón de residencia mediante el análisis de rasgos no métricos, obteniendo resultados compatibles con la información etnohistórica (Lane y Sublett Reference Lane and Sublett1972). En pueblos Urubu-Ka'apor de la Amazonia el análisis de 20 loci polimórficos comprobó la mayor variabilidad genética femenina entre grupos (divergencia fenotípica Fst = 0,0609) con relación a la variabilidad masculina (Fst = 0,0218) por diferentes tasas migratorias, confirmando un patrón de residencia matrilocal (Souza Aguiar y Neves Reference Souza Aguiar and Neves1991). En grupos antiguos asociados con concheros en los estados de Paraná y de Santa Catarina del sur de Brasil, empleando rasgos fenotípicos se comprobó la transición de grupos precerámicos con un patrón matrilocal a un patrón patrilocal en el período cerámico (Hubbe et al. Reference Hubbe, Neves, Castro de Oliveira and Strauss2009).
En Tailandia se determinó una fuerte correlación entre la variación de ADN mitocondrial (mtDNA) y del cromosoma Y con migraciones sexo-específicas en tribus con patrones residenciales matri- y patrilocales (Oota et al. Reference Oota, Settheetham-Ishida, Tiwawech, Ishida and Stoneking2001). En la región oriental de Estados Unidos con marcadores para mtDNA y del cromosoma Y se comprobaron historias demográficas diferentes entre poblaciones nativas de los territorios nororiental y sudoriental, dominando en el primero una pauta de residencia patrilocal y, en el segundo, matrilocal (Bolnick et al. Reference Bolnick, Bolnick and Smith2006). Schillaci y Stojanowski (Reference Schillaci and Stojanowski2003) examinaron la residencia posmarital de Pueblo Bonito del Cañón del Chaco al norte de Nuevo México, estableciendo que las diferencias de las varianzas univariadas para nueve variables craneométricas indicaban un patrón de mayor variabilidad femenina consistente con la residencia patrilocal o bilocal. Ambos autores destacan la importancia del estudio de la variación fenotípica sexo-específica que permite la estimación de las prácticas de residencia posmarital, un tema de trabajo importante para comprender diversos aspectos de la organización social prehistórica (Stojanowski y Schillaci Reference Stojanowski and Schillaci2006).
Además, se ha comprobado que los diversos patrones observados en los sistemas uniparentales (mtDNA y cromosoma Y) dependen de un comportamiento migratorio sexo-específico relacionado con varios factores: diferencias en ambos sexos en la tasa migratoria, en el tamaño efectivo y en la varianza del éxito reproductivo, en las pautas de descendencia y en la transmisión del éxito reproductivo (Heyer et al. Reference Heyer, Chaix, Pavard and Austerlitz2012). Es interesante la comprobación realizada en Asia interior sobre el comportamiento más estructurado del sexo masculino (Y-STRs), cuya diversidad se relaciona con una pauta patrilineal y patrilocal comparado con el femenino (HVS1), cuya variación se explica mejor geográficamente (Marchi et al. Reference Marchi, Hegay, Mennecier, Georges, Laurent, Whitten, Endicott, Aldashev, Dorzhu, Nasyrova, Chichlo, Ségurel and Heyer2016). En los últimos 10.000 años el análisis de una extensa muestra de poblaciones antiguas a nivel mundial determinó una tendencia hacia la residencia matrilocal, sobre la base de la información de mtDNA y de los isótopos del estroncio (87Sr/86Sr), resultado que refleja la misma tendencia en grupos cazadores y recolectores actuales (Brewer Reference Brewer2016).
En el Área Andina Centro-Sur (AACS) no existen antecedentes sobre el tema desde la arqueología ni desde la bioantropología. Tampoco se conocen otros trabajos interesados en la recuperación de esta información, aunque una experiencia reciente basada en el análisis de haplotipos mtDNA y cromosoma Y (Y-STRs) en sitios de la Quebrada de Humahuaca proporciona una evidencia preliminar al detectar un patrón de residencia matrilocal (Mendisco et al. Reference Mendisco, Keyser, Seldes, Nielsen, Russo, Crubezy and Ludes2018; Russo et al. Reference Russo, Mendisco, Avena, Dejean and Seldes2016).
En el presente trabajo se exploran a partir de rasgos fenotípicos las relaciones de parentesco y el patrón de residencia de poblaciones antiguas de una vasta extensión del AACS que abarca el Norte de Chile (NCH) y el Noroeste Argentino (NOA) con un amplio registro cronológico (4.000 años) con la finalidad de reconstruir las costumbres y pautas que regulaban las relaciones sociales de las sociedades del pasado y su proyección en la actualidad.
Material y Métodos
Integración de la Muestra
La muestra empleada fue obtenida en dos regiones relacionadas desde el punto de vista arqueológico e histórico, el NCH y el NOA, cada una de ellas integrada por cuatro localidades (Figura 1 y Tabla 1). A continuación, se brindan referencias cronológicas y contextuales de las localidades que integran cada región.
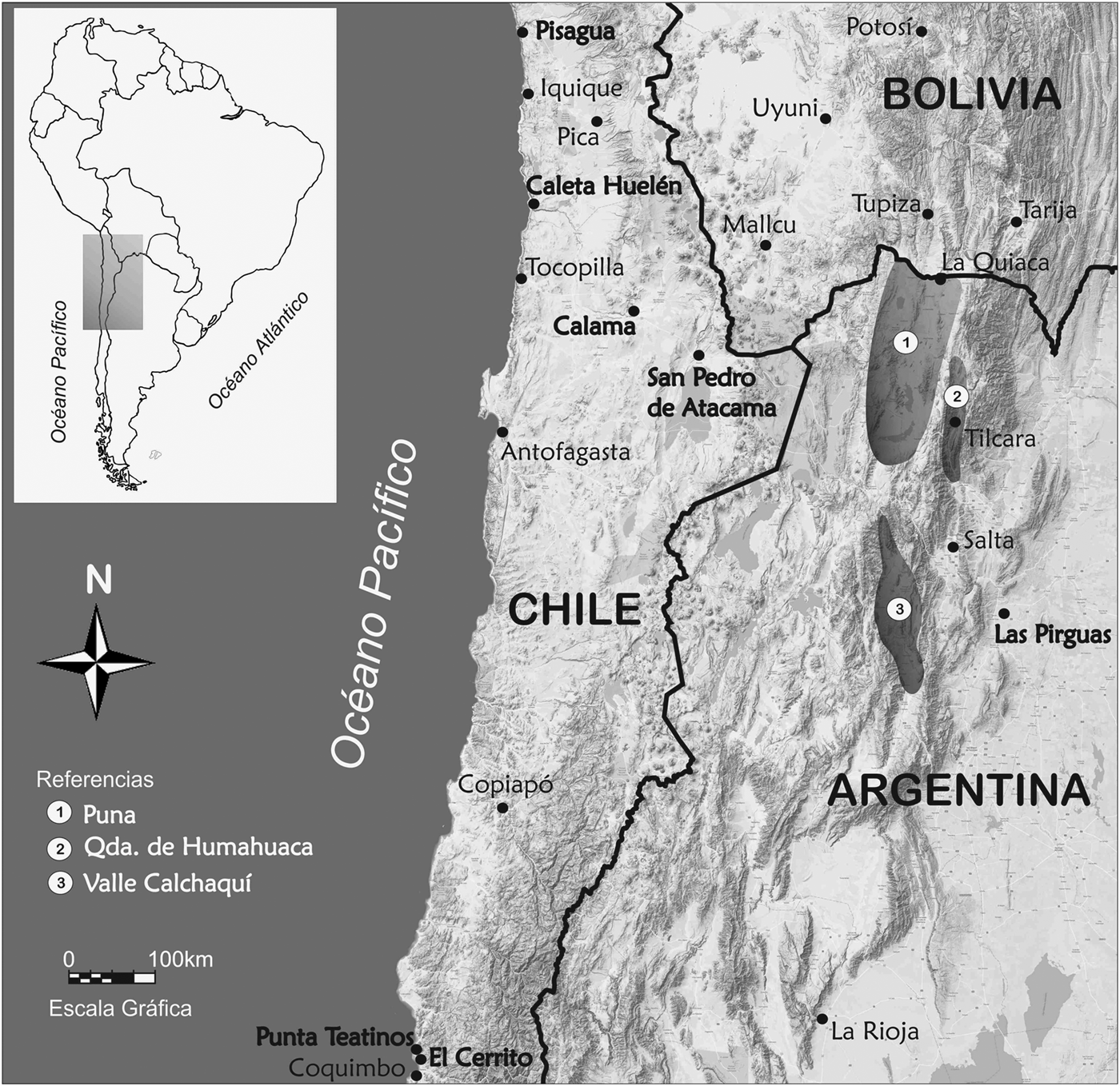
Figura 1. Localidades del Norte de Chile y Noroeste Argentino.
Tabla 1. Integración de la Muestra. Regiones, Localidades y Sitios.

Nota: N masc: tamaño muestral masculino; N fem: tamaño muestral femenino; N total: tamaño muestral regional. Los porcentajes entre paréntesis representan la proporción relativa de sexos en cada región.
El NCH comprende: Costa Norte, Calama, Norte Semiárido y San Pedro de Atacama. La Costa Norte involucra a Pisagua, que comprende un conjunto de sitios del período Agroalfarero (de 300 aC a 1450 dC) con una subsistencia basada en recursos marinos y continentales (Agüero Reference Agüero1995, Reference Agüero and Demestre2009; Cocilovo Reference Cocilovo1994; Cocilovo, Quevedo, Varela, Valdano y Castro Reference Cocilovo, Quevedo, Varela, Valdano and Castro1999; Quevedo y Cocilovo Reference Quevedo and Cocilovo1995) y a Caleta Huelén 42, del período Arcaico con fechas de 4780 ± 100 aP (Núñez et al. 2010:368), con una economía marítima con énfasis en la recolección de productos marinos y de vegetales, anzuelos de concha con vástago recto y estructuras habitacionales sencillas semicirculares (Cocilovo et al. Reference Cocilovo, Varela, Costa-Junqueira and Quevedo2005; Llagostera Reference Llagostera, Hidalgo, Schiappacasse, Niemeyer, Aldunate and Solimano1989; Núñez Reference Núñez1976; Zlatar Reference Zlatar1983). Calama (Chunchuri) corresponde al período Tardío e Inkaico y comprende materiales recuperados por Max Uhle: cuerpos inhumados en tumbas colectivas e individuales, junto con bienes materiales como cerámica, cestería y madera, instrumentos para rapé, implementos agrícolas, artefactos asociados con la minería, textilería y objetos de metal. El sitio se encuentra a orillas del Río Loa a 100 km de San Pedro de Atacama y posee una fecha de 1390 dC (Cocilovo et al. Reference Cocilovo, Varela and Valdano2016; Núñez Reference Núñez1965, Reference Núñez1968, Reference Núñez1976; Núñez y Pimentel Reference Núñez and Pimentel2008; Núñez et al. Reference Núñez, Agüero P., Cases C and de Souza H.2003). La muestra de San Pedro de Atacama (400–1535 dC) procede de los sitios de Quitor Conde Duque, Quitor 1, 2, 5, 6, 8 y 9, Larache, Coyo Oriental, Solcor 3, Toconao, Yaye 1, 2, 3 y 4, Yaye Occidental y Catarpe (Varela y Cocilovo Reference Varela and Cocilovo2011) y corresponde a la etapa agroalfarera de los períodos Temprano, Medio y Tardío (Núñez Reference Núñez1965). Por último, el Norte Semiárido integra los sitios de Punta de Teatinos y El Cerrito, con fechas de 4905 ± 100 aP y 4560 ± 95 aP para el primero (Schiappacasse y Niemeyer Reference Schiappacasse F. and Hans Niemeyer1986:95) y 3780 ± 550 aP para el segundo (Kuzmanic y Castillo Reference Kuzmanic and Castillo1986:89), correspondientes a cazadores y pescadores del litoral costero de Chile (Kuzmanic y Castillo Reference Kuzmanic and Castillo1986; Quevedo Reference Quevedo1976, Reference Quevedo1998; Schiappacasse y Niemeyer Reference Schiappacasse F. and Hans Niemeyer1986).
El NOA comprende cuatro localidades: Puna de Jujuy, Quebrada de Humahuaca, Valle Calchaquí y Selvas Occidentales. La Puna de Jujuy está integrada por un conjunto de sitios (Tabla 1) cuyos materiales corresponden al período Tardío con fechados entre 1029-1208 dC (± 2σ; Fuchs y Varela Reference Fuchs and Varela2013:555) y 1400-1497 dC (± 2σ; Fuchs Reference Fuchs2014:131), con una economía basada en el pastoreo de camélidos y agricultura. La Quebrada de Humahuaca comprende una serie de sitios de los períodos Medio y Tardío (650-1550 dC; Cocilovo, Varela, Baffi y Valdano Reference Cocilovo, Varela, Baffi and Valdano1999; Nielsen, Reference Nielsen1996; Otero y Rivolta Reference Otero and Rivolta2015; Varela et al. Reference Varela, Cocilovo, Baffi and Valdano1999). El Valle Calchaquí involucra sitios con cronologías correspondientes a los períodos de Desarrollos Regionales e Inka (1000-1550 dC), con una economía basada en la crianza de camélidos, agricultura en cuadros, canchones y andenes de cultivo (Baffi y Cocilovo Reference Baffi and Cocilovo1990; Baldini et al. Reference Baldini, Baffi, Quiroga and Villamayor2004; Sprovieri Reference Sprovieri2014). La localidad de Selvas Occidentales está representada por materiales de un conjunto de siete cavernas en el Bolsón de Las Pirguas (Salta). Por la cerámica este sitio se vincula con la cultura de La Candelaria del período Temprano (Baffi et al. Reference Baffi, Torres and Cocilovo1996; González Reference González1972), con un fechado de 1310 ± 40 aP (Carnese et al. Reference Carnese, Mendisco, Keyser, Dejean, Dugoujon, Bravi, Ludes and Crubézy2010:455) y calibrado de 680-774 dC (± 1σ; Varela y Cocilovo Reference Varela, Cocilovo, Ubelaker and Colantonio2019).
Métodos y Técnicas de Análisis
El trabajo para el AACS en general y para las dos regiones que lo integran (NOA y NCH) se realizó considerando los siguientes diseños experimentales: 1) análisis de la distribución de los sexos, 2) caracterización de los fenotipos medios y evaluación de las diferencias entre regiones y sexos, 3) evaluación de la varianza generalizada entre ambos sexos y 4) estimación del estadístico Fst y del flujo migratorio. Se utilizó una muestra de 1.897 individuos, de edades juvenil, adulto, maduro y senil, con y sin deformación artificial del cráneo. El diagnóstico del sexo, de la edad y de la deformación artificial se realizó de acuerdo con Bass (Reference Bass1971:13–14), Brothwell (Reference Brothwell1981:59–72), Buikstra y Ubelaker (Reference Buikstra and Ubelaker1994:32–38, 47–53), Dembo e Imbelloni (Reference Dembo and Imbelloni1938) y Genovés (Reference Genovés1962). Se emplearon 27 variables métricas (Tabla Suplementaria 1) definidas por la Convención Internacional de Mónaco (en Comas [Reference Comas1966]) y Wilder (Reference Wilder1920), utilizando instrumentos originales de Siber y Hegner (Suiza).
Los fenotipos de cada localidad, de ambos sexos y de cada sexo por región se analizaron con métodos estadísticos multivariados: análisis multivariado de la varianza (MANOVA) y análisis discriminante (Seber Reference Seber1984). La divergencia entre las poblaciones se evaluó por el estadístico Fst para rasgos cuantitativos de acuerdo con Konigsberg y Ousley (Reference Konigsberg and Ousley1995), Relethford (Reference Relethford1994, Reference Relethford1996), Relethford y Blangero (Reference Relethford and Blangero1990), Relethford y Harpending (Reference Relethford and Harpending1994) y Relethford et alia (Reference Relethford, Crawford and Blangero1997). Con el estadístico Fst se midió la magnitud de la diferenciación genética a partir de la relación de la varianza promedio entre y dentro de grupos (Varela y Cocilovo Reference Varela and Cocilovo2000, Reference Varela and Cocilovo2002). El cálculo se realizó con una heredabilidad (h 2) de 0,55 —un valor aceptable de acuerdo con Relethford (Reference Relethford1994) y Relethford y Harpending (Reference Relethford and Harpending1994). Este valor es compatible con la varianza genética máxima estimada para caracteres cuantitativos en poblaciones locales (Medeot et al. Reference Medeot, Cocilovo and Varela2008; Varela y Cocilovo Reference Varela and Cocilovo1999, Reference Varela and Cocilovo2007) según el desarrollo de Falconer y Mackay (Reference Falconer and Mackay1996). Se empleó el programa RMET versión 5.0 (Relethford Reference Relethford2003) asignando un valor de 1 al parámetro del tamaño poblacional.
Se incluyó el cálculo del flujo migratorio según el desarrollo original de Wright (Reference Wright1951) como Nm = 0,25 × [(1/Fst) - 1], siendo Nm el número de individuos migrantes por generación. Además, se evaluaron los determinantes (varianza generalizada) de las matrices de varianza-covarianza entre individuos masculinos y femeninos para tres grupos geográficos (AACS, NCH y NOA). Este análisis supone que el sexo de mayor varianza entre grupos define un patrón de residencia determinado. Una varianza femenina mayor que la masculina indicaría un patrón de residencia patrilocal, y una varianza masculina mayor que la femenina revelaría un patrón de residencia matrilocal (Konigsberg Reference Konigsberg1988). Ambos casos se relacionan con circuitos, tasas migratorias o tamaños efectivos diferentes. Esta evaluación está acompañada por el análisis de valores D 2 de Mahalanobis y del estadístico Fst para los siguientes diseños: 1) entre sexos a nivel global (AACS), 2) entre sexos por regiones (NOA y NCH), 3) entre masculinos por regiones, 4) entre femeninos por regiones, 5) entre sexos del NCH y entre sexos del NOA.
Resultados
La distribución del sexo en la muestra total (Tabla 1) reveló una mayoría de individuos masculinos (57,41%), condición que se repite en las regiones NCH y NOA (χ2 = 6,456; gl = 1; p = 0,011). Existen diferencias fenotípicas significativas entre regiones (Lambda de Wilks: 0,527 aprox.; F = 62,036; gl = 27, 1869; p < 0,001; Figura 2) e igualmente entre las localidades que integran el NCH y NOA (Lambda de Wilks: 0,059 aprox.; F = 34,740; gl = 189, 12675; p < 0,001). Con relación al posible efecto de la deformación artificial en los resultados no se obtuvieron pruebas suficientes como para aceptar una diferencia estadística significativa entre individuos deformados y no deformados con relación al sexo (Lambda de Wilks: 0,972 aprox.; F = 1,005; gl = 54, 3730; p = 0,464).

Figura 2. Distribución de las regiones Norte de Chile (NCH) y Noroeste Argentino (NOA) por la coordenada discriminante 1 (proporción acumulada 100%). Número de variables en el modelo = 27, Lambda de Wilks = 0,527 aprox.; F = 62,036 ; gl = 27, 1869 ; p < 0,001.
El análisis de reclasificación entre NOA y NCH reveló una mayor proporción de casos asignados al propio grupo y una menor proporción asignada a un grupo distinto del original. En el caso del NOA dichas proporciones son 82% y 18%, mientras que para NCH alcanzaron 83% y 17%, respectivamente.
Se obtuvieron resultados significativos al evaluar las diferencias entre sexos para el AACS, NCH y NOA (Lambda de Wilks: 0,605 aprox.; F = 45,221; gl = 27, 1869; p < 0,001) y al calcular los valores D 2 respectivos (D 2AACS = 3,58; D 2NCH = 3,74 y D 2NOA = 2,44; todos con p < 0,001). Igualmente, las diferencias entre sexos por región también son significativas en general (Lambda de Wilks: 0,297 aprox.; F = 34,556; gl = 81, 5584; p < 0,001) y para cada caso sobre la base de las pruebas D 2 (todas con gl = 27, 1867 y p < 0,001), superando el valor D 2 femenino en 24% al valor masculino.
En la Figura 3 se muestra el dendrograma con el agrupamiento de los sexos por región (método de Ward). Se observa un mayor dimorfismo sexual en el NCH con relación al NOA. En lo que respecta a los determinantes de las varianzas-covarianzas entre sexos por grupos y el cociente entre ambas (masculinos/femeninos) para AACS (8 localidades), NCH (4 localidades) y NOA (4 localidades), debe destacarse que, en todos los casos, los valores de los determinantes masculinos (M) son mayores con relación a los valores femeninos (F), considerando los cocientes M/F: 8,80 para AACS, 3,75 para NCH y 21,84 para NOA, respectivamente (Tabla 2).

Figura 3. Dendrograma basado en valores D 2, distribución de los sexos por región (Lambda de Wilks: 0,297 aprox.; F = 34,556 ; gl = 81, 5584 ; p < 0,001) para individuos masculinos y femeninos del Norte de Chile (NCHMAS y NCHFEM) y del Noroeste Argentino (NOAMAS y NOAFEM).
Tabla 2. Determinantes de Matrices de Varianza-Covarianza y Relación de Proporcionalidad entre Sexos.

La estructura de la población regional medida por el estadístico Fst (Tabla 3) reveló la magnitud de la divergencia genética y el número estimado de migrantes por generación (Nm) para distintos diseños experimentales. Entre regiones la divergencia fenotípica se estimó en Fst = 0,0287 ± 0,0010 con una proporción migratoria de 8,5 individuos por generación y entre sexos y regiones (NOA-NCH) se obtuvo el valor máximo de Fst = 0,0530 ± 0,0014, con 4,5 individuos migrantes por generación. Entre masculinos por regiones se obtuvo Fst = 0,0273 ± 0,0013 y Nm = 8,9 individuos migrantes, mientras que para femeninos resultó Fst = 0,0360 ± 0,0017 y Nm = 6,7 individuos. La divergencia fenotípica entre ambos sexos del NCH entre localidades es Fst = 0,0297 ± 0,0015 con Nm = 8,2 individuos migrantes y es menor entre ambos sexos del NOA con Fst = 0,0201 ± 0,0013 y Nm = 12,2, indicando así una menor divergencia y un mayor flujo génico de migrantes por generación entre localidades.
Tabla 3. Valores Fst, Errores Estándar y Migrantes por Generación.

Nota: ee: error estándar; Nm: número de migrantes por generación.
En la Figura 4 se presenta el modelo esperado de equilibrio entre la deriva y la migración marcado por la línea recta que cruza en diagonal y la distribución de los sexos de los grupos por la varianza observada y esperada (Fst = 0,0530 ± 0,0014). Los varones del NOA se apartan del equilibrio en forma marcada (mayor heterocigosidad) por su relación con un circuito migratorio externo, a diferencia del sexo masculino del NCH que presenta un balance entre los efectos de la deriva génica y de la migración. Las mujeres del NOA y NCH presentan una varianza menor que la esperada debido a un menor tamaño efectivo y un circuito migratorio más restringido. En general, la mayor proporción migratoria (Nm) entre regiones se manifiesta en varones (Tabla 3) y entre ambos sexos del NOA.

Figura 4. Varianza fenotípica observada (rombos) y esperada (cuadrados) para individuos masculinos y femeninos del Norte de Chile (NCHMAS y NCHFEM) y del Noroeste Argentino (NOAMAS y NOAFEM). Fst = 0,0530 ± 0,0014.
Discusión
La particular distribución de los sexos entre las regiones marca una propiedad que se repite en algunas localidades (Calama y Puna de Jujuy) en las que predominan significativamente los individuos masculinos. Esta relación puede ser el resultado de diferentes prácticas laborales por las cuales los hombres se vinculaban mayormente con el tráfico de productos en una amplia red de localidades circulando en un espacio territorial mayor que el de las mujeres.
Las diferencias fenotípicas entre regiones (Figura 2) confirman los resultados de experiencias anteriores (Cocilovo, Varela, Fuchs y Valdano Reference Cocilovo, Varela, Fuchs and Valdano2017; Cocilovo, Varela y Valdano Reference Cocilovo, Varela and Valdano2017; Varela et al. Reference Varela, O'Brien and Cocilovo2008) y sustentan dos modelos de adaptación y desarrollo en ambas vertientes andinas (NCH y NOA) entre las cuales la circulación de personas, el intercambio de productos y el tráfico caravanero entre localidades remotas consolidó un vasto sistema andino de subsistencia. Los valores D 2 entre localidades por región (NCH: 3,74 y NOA: 2,44) reflejan claramente la distinta composición genética de las poblaciones. El valor D 2NCH = 3,61 entre sexos que se distribuyen en un espacio mucho más amplio supera en un 51% al valor D 2NOA = 2,39. Estos hechos se relacionan con la disminución proporcional del parentesco con la distancia temporal y espacial entre regiones, localidades y sitios. Por ejemplo, la distancia lineal máxima entre sitios de NCH es de 1.400 km, entre sitios del NOA es de 548 km y globalmente entre ambas regiones, cordillera mediante, es de 1.300 km. En el NCH la diferencia temporal entre localidades fue aproximadamente de 470 generaciones y en el NOA de 30 generaciones. Las diferencias fenotípicas reflejan historias de vida distintas en ambas vertientes de la cordillera andina como resultado de la dispersión espacial, de la deriva génica, de la migración y de las pautas culturales que determinaron las estructuras de las poblaciones.
La varianza fenotípica observada en el NOA explica la integración de la población con una composición genética de un amplio rango (mayor heterocigosis), lo cual se determina con mayor aproximación cuando se comparan los sexos por regiones (Figura 4): el grupo masculino del NOA se aparta del equilibrio esperado en forma marcada por la influencia de un flujo génico extrarregional. En general, por región el sexo masculino posee una menor divergencia entre grupos (2,7%) y la mayor tasa migratoria (aproximadamente 9 individuos por generación) con relación a la divergencia femenina (3,6%) y la tasa migratoria (aproximadamente 7 individuos por generación; Tabla 3). La existencia de flujo génico entre el NOA y NCH y, en general, en el AACS está de acuerdo con la evidencia etnográfica (Difrieri Reference Difrieri1980) y con la información fenotípica y genética disponible en la actualidad (Cocilovo, Varela y Fuchs Reference Cocilovo, Varela and Fuchs2017; Cocilovo, Varela, Fuchs y Valdano Reference Cocilovo, Varela, Fuchs and Valdano2017; Postillone et al. Reference Postillone, Fuchs, Crespo, Russo, Varela, Carnese, Avena and Dejean2017; Varela et al. Reference Varela, Cocilovo, Baffi and Valdano1999, Reference Varela, O'Brien and Cocilovo2008, Reference Varela, Cocilovo and O'Brien2013, Reference Varela, Cocilovo, Fuchs and O'Brien2014).
Las pruebas obtenidas indican una estructura poblacional compleja por las distintas propiedades de ambos sexos en cuanto a la variación genética local y regional relacionadas con pautas de residencia (patrilocal o matrilocal), casamientos preferenciales y alianzas matrimoniales entre otros factores. La homogeneidad fenotípica de las mujeres entre localidades indica un mayor aporte genético local y un menor tamaño efectivo. Es posible que este evento sea el resultado de un modelo de residencia matrilocal. De acuerdo con lo esperado esta relación se confirma a nivel del AACS y de las regiones NCH y NOA por la mayor varianza generalizada entre grupos del sexo masculino con relación al femenino (Tabla 2). Este resultado se acompaña con el valor Fst femenino 32% mayor que el masculino entre regiones y una menor tasa migratoria (Tabla 3). Es decir, en las mujeres la variación genética entre grupos es mayor que la variación dentro de grupos y a la inversa, los hombres poseen una varianza entre grupos menor que la varianza dentro de grupos por un circuito migratorio de un rango territorial más amplio. Las mujeres habrían adquirido una menor variabilidad genética y un menor tamaño efectivo en un circuito territorial restringido. Sin embargo, la divergencia entre regiones es producida en mayor grado por el grupo masculino del NOA integrando la variabilidad genética de un territorio mayor (Figura 4). En general, la tasa migratoria masculina es 33 veces mayor que la femenina (Tabla 3). Estas observaciones confirman y amplían los resultados obtenidos con anterioridad abarcando un territorio menor al comparar Puna de Jujuy con San Pedro de Atacama, Calama y Pisagua (Cocilovo, Varela, Fuchs y Valdano Reference Cocilovo, Varela, Fuchs and Valdano2017; Cocilovo, Varela y Valdano Reference Cocilovo, Varela and Valdano2017). La mayor divergencia se registró entre los sexos en ambas regiones (5,3%; Tabla 3).
Los resultados presentados son consistentes con el patrón residencial esperado de acuerdo con Konigsberg (Reference Konigsberg1988:471): “Si un sexo posee una mayor movilidad dentro de un circuito migratorio y una mayor tasa migratoria, su varianza genética entre grupos será menor y mayor la varianza dentro del grupo con relación al sexo menos móvil en la generación actual” [traducido por los autores]. Además, las diferencias en el tamaño efectivo entre sexos pueden ser explicadas por la variación y la trasmisión del éxito reproductivo (poliginia) y las reglas de descendencia (Heyer et al. Reference Heyer, Chaix, Pavard and Austerlitz2012). En suma, de acuerdo con Ensor (Reference Ensor2011:203) los resultados obtenidos brindan “una oportunidad para que los arqueólogos expliquen las transformaciones sociales en el pasado remoto” [traducido por los autores].
Conclusiones
Las diferencias fenotípicas entre regiones y entre sexos son significativas, concuerdan con los valores Fst estimados y con la proporción de individuos migrantes por generación y sustentan el efecto de las distancias espaciales y temporales en la divergencia genética entre poblaciones. La estructura de la población fue determinada por la magnitud de la deriva y del efecto migratorio regional que influyó más en la composición del sexo masculino, mientras que la composición genética femenina estuvo determinada por la mayor actividad en circuitos migratorios locales. A nivel regional la mayor varianza entre grupos de los individuos masculinos con respecto a los femeninos indicó un patrón de residencia matrilocal. Los resultados obtenidos promueven la continuidad de la investigación en el NCH y en el NOA para evaluar en el espacio y en el tiempo la influencia de las reglas de parentesco y los sistemas económicos que determinaron los patrones de residencia durante los avatares de la historia precolonial.
Agradecimientos
La realización del presente estudio fue posible gracias al apoyo brindado por el Consejo Nacional de Investigaciones Científicas y Técnicas (PIP 112201101 00833) y la Secretaría de Ciencia y Técnica, Universidad Nacional de Río Cuarto (SeCyT-UNRC, 161/16 C506, 16–17). Agradecemos también a la Dirección y al Personal del Museo Etnográfico “Juan B. Ambrosetti” (Universidad de Buenos Aires), al Museo de La Plata (Universidad Nacional de La Plata), al Museo Nacional de Historia Natural de Santiago (Chile) y al Museo e Instituto de Investigaciones de San Pedro de Atacama (Chile) por la colaboración brindada durante el relevamiento de la información empleada en este trabajo desde 1981 hasta el presente. También deseamos manifestar nuestro reconocimiento a Silvina Rodríguez Curletto por la confección del mapa regional y a los revisores por sus sugerencias y opiniones que permitieron mejorar el presente trabajo.
Declaración de Disponibilidad de Datos
Los datos utilizados se encuentran disponibles tanto en la presente publicación como en otros trabajos ya publicados. En caso de que sean necesarios datos más detallados, estos pueden ser solicitados a los autores.
Materiales Suplementarios
Para acceder a los materiales suplementarios que acompañan este artículo visitar https://doi.org/10.1017/laq.2019.23.
Tabla Suplementaria 1: Mediciones Craneométricas.









