La lutte anti-vectorielle: diversité des approches
Plusieurs espèces de moustiques (Diptera: Culicidae), appartenant notamment aux genres Aedes Meigen, Culex Linnaeus ou Anopheles Meigen, sont des vecteurs d’organismes pathogènes responsables de zoonoses d’incidence médico-vétérinaire considérable (Goddard Reference Goddard2008). Les femelles, par le biais d’un repas de sang sur un hôte vertébré, sont capables de contracter et véhiculer trois types d’agents infectieux selon les espèces de moustiques: (1) des virus responsables de nombreuses arboviroses (dengue, chikungunya, fièvre du Nil occidental, fièvre de la vallée du Rift, ou encore fièvre jaune), (2) des protozoaires du genre Plasmodium Marchiafava et Celli responsables du paludisme, et (3) des nématodes responsables de filarioses (en particulier la filariose lymphatique et la dirofilariose) (Goddard Reference Goddard2008; Mullen et Durden Reference Mullen and Durden2009). Actuellement, une modification de la distribution géographique de ces vecteurs majoritairement causée par des facteurs anthropiques est accompagnée de (ré)émergences de maladies infectieuses notamment en Europe et en Amérique du Nord (Reiter Reference Reiter2001; Jones et al. Reference Jones, Patel, Levy, Storeygard, Balk, Gittleman and Daszak2008; Gould et Higgs Reference Gould and Higgs2009; Randolph et Rogers Reference Randolph and Rogers2010; Medlock et al. Reference Medlock, Hansford, Schaffner, Versteirt, Hendrickx, Zeller and Van Bortel2012; Bonizzoni et al. Reference Bonizzoni, Gasperi, Chen and James2013).
Historiquement, la lutte anti-vectorielle fut une composante essentielle pour la gestion de la santé publique. Actuellement, la prise en compte des changements globaux (climatiques, démographiques et socio-économiques) et de la nécessité de développement durable constitue un nouveau défi. Pour répondre à ces attentes, la lutte anti-vectorielle doit aujourd’hui faire appel à l’utilisation de techniques variées. Tout comme dans les domaines agricoles et forestiers, un concept de lutte intégrée est désormais requis.
Gestion environnementale et contrôle physique
La base de toute lutte anti-vectorielle repose sur une gestion environnementale des populations de moustiques (Organisation mondiale de la Santé 1982) qui passe tant par une modification des habitats destinée à prévenir, limiter ou supprimer les gîtes larvaires potentiels (drainage de milieux humides, traitement des eaux usées, remblai) que par une adaptation du comportement humain en vue de réduire au mieux le contact hôte-vecteur (gestion des déchets, suppression ou bâchage de récipients d’eau potentiels). Cette technique de gestion élémentaire fut prépondérante jusqu’à l’avènement des insecticides de synthèse lors de la seconde guerre mondiale. Suivant les avancées scientifiques et technologiques du moment (Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010), elle a pu être renforcée par des moyens physiques et mécaniques, tels l’épandage d’huile à la surface des eaux ou encore le piégeage massif des adultes à proximité des habitations. L’importance de ces méthodes est capitale en milieu urbain car elles permettent la prévention et la réduction de l’abondance des espèces anthropophiles dangereuses telles Aedes aegypti (Linnaeus) et Aedes albopictus (Skuse) (Fontenille et al. Reference Fontenille, Lagneau, Lecollinet, Lefait Robin and Setbon2009). Cependant, cette technique peut être difficilement applicable dans le cas de zones rurales humides d’importance économique (rizières, marais salants). De même, son manque évident de sélectivité la rend peu intéressante lorsqu’il s’agit de conserver intacts des milieux humides naturels à valeur écologique. La gestion environnementale peut enfin être limitée par un coût parfois énorme et difficile à assumer malgré une protection efficace; cet investissement ne peut se justifier par rapport au coût d’autres méthodes de lutte que sur le long terme (p.ex. pratiquer le remblai d’une zone humide plutôt que de la pulvériser de façon récurrente) et/ou si des bénéfices supplémentaires (p.ex. le drainage d’un territoire qui profite à l’agriculture) peuvent être pris en compte.
Contrôle chimique
Les moyens de contrôle chimique se sont diversifiés dans le temps (Regnault-Roger Reference Regnault-Roger2005; Yu Reference Yu2008; Rattner Reference Rattner2009; Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010; Tableau 1). Des insecticides inorganiques (notamment dérivés de l’arsenic) étaient utilisés en grande majorité jusqu’à la seconde guerre mondiale. C’est à ce moment que l’avènement des insecticides organiques de synthèse eut lieu, généralement associé à la découverte par Paul Hermann Müller en 1939 des propriétés insecticides d’un organochloré: le DDT (dichloro-diphényl-trichloroéthane; Organisation mondiale de la Santé 1989). Dans un contexte de guerre, ce produit fut utilisé intensivement par les Alliés pour lutter contre les vecteurs du typhus et du paludisme, permettant de sauver des milliers de vies. Le DDT fut commercialisé par la suite à des fins agricoles et repris dans des programmes d’éradication de maladies infectieuses à travers le monde (notamment la « Campagne mondiale d’éradication du paludisme » initiée en 1955 par l’Organisation mondiale de la Santé). Plusieurs familles d’insecticides organiques de synthèse ont également vu le jour durant cette seconde moitié du 20e siècle, permettant une lutte contre de nombreuses espèces d’insectes nuisibles tant en lutte anti-vectorielle qu’en agriculture. C’est ainsi que les organophosphorés furent développés peu après le DDT durant la seconde guerre mondiale, et que les carbamates furent produits à grande échelle au cours des années 1950. L’efficacité remarquable de ces trois grandes familles, agissant toutes au niveau du système nerveux des insectes, a conduit à la suprématie des insecticides organiques de synthèse entre 1950 et 1970. Mais les dégâts collatéraux causés dans les écosystèmes aquatiques et terrestres par ces composés bio-accumulables et peu sélectifs (Rattner Reference Rattner2009; Mitra et al. Reference Mitra, Chatterjee and Mandal2011), de même que les problèmes sanitaires résultants de la pollution des eaux de surface et des nappes phréatiques (Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010; Roberts et al. Reference Roberts, Karr, Paulson, Brock-Utne, Brumberg and Campbell2012), furent mis en évidence dès le début des années 1960 (Carson Reference Carson1962) justifiant le retrait de certains de ces insecticides (dont le DDT). Leur utilisation intensive fut également responsable d’une apparition de résistances dans certaines populations d’insectes, limitant leur efficacité (Hamon et Garret-Jones Reference Hamon and Garret-Jones1963; Hamon et al. Reference Hamon, Subra, Sales and Coz1968, Reference Hamon, Mouchet, Brengues and Chauvet1970; Hemingway et Ranson Reference Hemingway and Ranson2000; Weill et al. Reference Weill, Luffalla, Mogensen, Chandre, Berthomieu and Berticat2003; Nauen Reference Nauen2007; Rivero et al. Reference Rivero, Vézilier, Weill, Read and Gandon2010; Ranson et al. Reference Ranson, N’Guessan, Lines, Moiroux, Nkuni and Corbel2011). Le besoin de méthodes alternatives fut dès lors mis en évidence. Une nouvelle génération d’insecticides apparut à partir des années 1970, tentant de pallier à ces inconvénients: ce sont les pyréthrinoïdes, les néonicotinoïdes et les régulateurs de croissance. Tout comme leurs prédécesseurs, ces insecticides se sont révélés d’une grande efficacité. Cependant, les problèmes liés aux pollutions environnementales et aux résistances des insectes continuent à persister, et compromettent leur utilisation à long terme (N’Guessan et al. Reference N’Guessan, Corbel, Akogbéto and Rowland2007; Temu et al. Reference Temu, Maxwell, Munyekenye, Howard, Munga and Avicor2012; Ochomo et al. Reference Ochomo, Bayoh, Brodgon, Gimnig, Ouma, Vulule and Walker2013; Riaz et al. Reference Riaz, Chandor-Proust, Dauphin-Villemant, Poupardin, Jones and Strode2013). Un exemple récent peut être donné par des souches d’Aedes aegypti d’Amérique latine résistantes à pas moins de six organophosphorés et quatre pyréthrinoïdes (Rodriguez et al. Reference Rodriguez, Bisset and Fernandez2007).
Tableau 1 Principaux groupes d’insecticides organiques de synthèse utilisés en lutte anti-vectorielle (d’après Yu Reference Yu2008; Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010).

1 Sn=Système nerveux
Contrôle biologique
Le contrôle biologique peut être défini comme « la réduction d’une population par l’utilisation de compétiteurs, prédateurs, parasites, pathogènes ou de toxines dérivées de ceux-ci » (Woodring et Davidson Reference Woodring and Davidson1996). Il s’agit ainsi de maintenir une population sous un seuil acceptable en termes de nuisance et de risque épidémique (dans le cas de la lutte anti-vectorielle) par l’intermédiaire d’un organisme (dit auxiliaire) ou de substances d’origine naturelle tout en évitant des effets délétères à l’écosystème. Ce concept est ancien: il remonterait à l’Égypte antique lors de la domestication du chat pour protéger les denrées alimentaires des rongeurs. L’appellation de « lutte biologique » en tant que telle ne fût néanmoins employée pour la première fois qu’au début du 20e siècle (Regnault-Roger Reference Regnault-Roger2005). Cependant, le développement et l’utilisation massive d’insecticides organiques de synthèse à partir de la seconde guerre mondiale furent un frein considérable à cette pratique. Ces produits, peu coûteux et simples d’utilisation, ne souffraient d’aucune concurrence tant dans les domaines de l’agriculture que de la lutte anti-vectorielle. Ce n’est que lors de la découverte des inconvénients majeurs de ces insecticides au début des années 1960 que le besoin d’agents de contrôle sélectifs fut mis en évidence et qu’un regain d’intérêt eu lieu pour la lutte biologique. Un tournant important fut la découverte de la toxicité sélective de certaines souches de Bacillus thuringiensis Berliner, rapidement développées sous forme de produits commerciaux insecticides (Regnault-Roger Reference Regnault-Roger2005; Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010). Par soucis de facilité, la distinction sera ici faite entre les organismes auxiliaires macroscopiques (les entomophages) et microscopiques (les entomopathogènes).
Les entomophages
La littérature scientifique regorge aujourd’hui d’utilisations à succès d’organismes entomophages. Cependant, cette pratique vaut essentiellement dans le domaine agricole (pensons à l’emblématique coccinelle et son puceron) et ne parvient pas à s’imposer en lutte anti-vectorielle (Kumar et Hwang Reference Kumar and Hwang2006; Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010). Dans le cas qui nous occupe, l’utilisation d’organismes prédateurs de moustiques est limitée par une production massive difficile et coûteuse, une activité prédatrice peu spécifique, ainsi qu’un déséquilibre potentiel des écosystèmes. Mammifères, Oiseaux, Amphibiens, Cnidaires, Plathelminthes, Arachnides, ou encore Insectes aquatiques se sont ainsi révélés peu efficaces en termes de régulation de population des moustiques (Kumar et Hwang Reference Kumar and Hwang2006; Raghavendra et al. Reference Raghavendra, Sharma and Dash2008; Shaalan et Canyon Reference Shaalan and Canyon2009; Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010; Tableau 2). Notons toutefois l’utilisation à succès de Copépodes du genre Mesocyclops Sars dans des récipients de stockage d’eau permettant d’éliminer les stades immatures d’Aedes aegypti au Vietnam (Nam et al. Reference Nam, Yen, Duc, Tu, Thang and Le2012). Une exception peut encore être faite des poissons prédateurs tels la gambusie (Gambusia affinis (Baird et Girard)) et le guppy (Poecilia reticulata Peters) (Chandra et al. Reference Chandra, Bhattacharjee, Chatterjee and Ghosh2008), mais ils sont rarement employés dans des programmes de gestion.
Tableau 2 Principaux groupes d’entomophages utilisés contre les moustiques et exemples d’espèces (d’après Kumar et Hwang Reference Kumar and Hwang2006; Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010).

Les entomopathogènes
Les organismes pathogènes ou parasites sont potentiellement plus intéressants dans le contrôle biologique des moustiques que les entomophages (Chapman Reference Chapman1974; Lacey et Undeen Reference Lacey and Undeen1986; Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010; Abdul-Ghani et al. Reference Abdul-Ghani, Al-Mekhlafi and Alabsi2012). Le terme de « lutte microbiologique » sera préféré car l’organisme antagoniste sera un micro-organisme: un champignon, une bactérie, un virus ou encore un protozoaire. Les nématodes sont également considérés comme tels. Ce concept aurait été initié à la fin du 19e siècle par Pasteur et de nombreux micro-organismes pathogènes envers divers insectes ont été mis en évidence depuis lors. Ces pathogènes possèdent la capacité de surpasser les défenses de l’insecte hôte et de l’infecter; ils s’y multiplient ensuite et provoquent sa mort à plus ou moins long terme que ce soit par l’émission de substances toxiques et/ou la destruction de certains tissus.
Contrôle génétique
Un contrôle génétique (c’est-à-dire par une altération ou un remplacement du matériel héréditaire) des moustiques selon deux stratégies est aussi envisageable (Alphey et al. Reference Alphey, Beard, Bittingsley, Coetzee, Crisanti and Curtis2002; Wilke et al. Reference Wilke, Gomes, de, Natal and Marrelli2009; Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010; Resnik Reference Resnik2012). (1) La lutte autocide consiste à introduire des individus stériles dont les accouplements ne permettront pas de descendance dans la population ciblée. Cette méthode spécifique à l’espèce de moustique repose sur l’élevage intensif, la stérilisation des mâles (n’effectuant pas de repas de sang), et le relargage de ceux-ci dans l’environnement. Elle n’a cependant permis d’obtenir des résultats qu’en milieu insulaire (isolé) du fait du peu de compétitivité des mâles stériles et de l’immigration de nouvelles souches de moustiques depuis des zones non traitées. De plus, un grand nombre d’individus doit être relâché pour que cette technique soit efficace, ce qui la rend coûteuse et peu abordable. Ainsi, la réduction de près de 99% de la population indigène de Culex quinquefasciatus Say d’une petite île (<1 km2) de Floride a été obtenue après la libération quotidienne de plusieurs milliers d’individus stériles sur une période de 12 jours (Patterson et al. Reference Patterson, Weidhaas, Ford and Lofgren1970). Au contraire, l’introduction de près de 85 000 mâles stériles de Culex tarsalis Coquillett dans un canyon semi-isolé de Californie n’a pas eu d’effet sur la population locale (Milby et al. Reference Milby, Reisen and Reeves1983). (2) Le remplacement d’une population par des individus rendus non compétents vis-à-vis d’un pathogène par le biais de manipulations génétiques (et dès lors incapables de le transmettre) semble prometteuse mais pose des problèmes d’ordre éthique et légal dans la mesure où l’impact de moustiques transgéniques sur l’environnement n’a pas été évalué (persistance des moustiques, apparition de phénotypes inattendus, expansion de maladies minoritaires non-ciblées). Par exemple, la surexpression de protéines Akt dans l’intestin moyen du moustique Anopheles stephensi Liston a permis de renforcer l’immunité de ce dernier et de réduire l’acquisition de sporozoites infectieux de Plasmodium falciparum Welch responsables du paludisme (Corby-Harris et al. Reference Corby-Harris, Drexler, Watkins de Jong, Antonova, Pakpour and Ziegler2010). Dans le même ordre d’idée, une nouvelle approche basée sur les micro-organismes symbiotiques du moustique permettrait d’annihiler sa capacité à transmettre un pathogène donné (Ricci et al. Reference Ricci, Damiani, Rossi, Capone, Scuppa and Cappelli2011): les symbiontes qui contribuent à cette capacité sont éliminés ou modifiés (paratransgénèse) de manière à rendre l’insecte incompétent vis-à-vis de l’agent infectieux. Parmi les symbiontes de moustiques connus, deux genres offrent des perspectives particulièrement intéressantes: Wolbachia Hertig et Asaia Yamada et al. Les défenseurs de cette approche revendiquent l’appellation de contrôle symbiotique.
La lutte microbiologique
La plupart des micro-organismes possèdent un spectre d’hôtes étroit de leur mode d’action spécifique, ce qui permet de limiter les effets sur les organismes non ciblés: c’est là leur atout commun. Le choix d’un agent de contrôle microbien dépend de l’espèce d’insecte ciblée, et par-delà des possibilités de conditionnement et d’application de l’agent lui-même. Plusieurs stratégies d’application de ces micro-organismes existent (Regnault-Roger Reference Regnault-Roger2005). Il peut s’agir de promouvoir les micro-organismes existant déjà dans l’environnement de l’insecte ciblé (augmentation), ou encore de les y introduire et les acclimater à long terme (inoculation). Mais les micro-organismes sont plus particulièrement indiqués pour être appliqués sous forme de biopesticides (inondation) pour un contrôle rapide des populations d’insectes.
Développement d’un biopesticide microbien
Que ce soit en agriculture ou en lutte anti-vectorielle, le développement d’un micro-organisme en tant qu’agent de contrôle suit le même schéma (Regnault-Roger Reference Regnault-Roger2005; Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010). (1) Celui-ci doit être isolé depuis l’environnement et caractérisé du point de vue taxonomique, écologique et physiologique. (2) Des milieux de culture adéquats doivent être développés. (3) Les souches les plus virulentes sont ensuite sélectionnées en laboratoire et en conditions environnementales. Pour se faire, une relation dose/mortalité est établie et l’efficacité du micro-organisme envers l’insecte ciblé (larve et/ou adulte) est classiquement traduite par la CL50 (concentration létale occasionnant 50% de mortalité), la DL50 (dose létale occasionnant 50% de mortalité) ou encore le TL50 (temps au cours duquel 50% de mortalité est observée). A cet égard, les larves de moustiques représentent une cible de choix car elles demeurent confinées dans les sites de ponte, à l’inverse des adultes qui tendent à se disperser dans l’environnement. Une série de recommandations a été publiée par l’Organisation mondiale de la Santé afin de standardiser les tests de toxicité (Organisation mondiale de la Santé 2005). (4) La virulence du micro-organisme envers les organismes non ciblés doit également être testée. (5) Une méthode de production massive des micro-organismes d’intérêt doit enfin être développée, de même que (6) une formulation (conditionnement) adéquate pour améliorer le stockage, augmenter l’efficacité, ou encore faciliter l’application du produit.
Les bactéries entomopathogènes
Diversité
Les bactéries entomopathogènes développées en tant qu’agents de lutte appartiennent pour la plupart aux familles des Bacillaceae Fischer et Enterobacteriaceae Rahn (Regnault-Roger Reference Regnault-Roger2005). Dans son ouvrage, Paillot (Reference Paillot1933) reconnaissait déjà le pouvoir infectieux de ces micro-organismes: selon les espèces, les bactéries entomopathogènes ont la capacité d’infecter leur hôte par voie intestinale (via leur ingestion), par voie tégumentaire (via les blessures) ou encore par le biais d’un parasite (notamment des nématodes). L’infection peut alors demeurer localisée dans une partie du corps de l’insecte, ou gagner l’hémolymphe et se révéler septicémique. Dans certains cas, la production de toxines entraine des lésions cellulaires et amène à la mort de l’insecte. Dans le cas des moustiques, les bactéries pathogènes les plus importantes appartiennent au genre Bacillus Cohn. Cette section se propose de se concentrer sur les principaux agents de lutte bactériens dirigés contre les moustiques: Bacillus thuringiensis var. israelensis et Bacillus sphaericus Neide (Lacey Reference Lacey2007). Il convient cependant de signaler l’existence d’autres souches d’intérêt, bien moins exploitées, pathogènes envers les moustiques; il en est ainsi de Bacillus thuringiensis var. jegathesan, Bacillus thuringiensis var. kurstaki, Bacillus laterosporus Laubach ou encore de Clostridium bifermentans (Weinberg et Séguin) (Porter Reference Porter1996; Charles et Nielsen-LeRoux Reference Charles and Nielsen-LeRoux2000; Tableau 3).
Tableau 3 Principaux groupes de bactéries affectant les moustiques, et espèces d’intérêt illustrant les genres concernés.

Le genre Bacillus
Le genre Bacillus (Bacillaceae) correspond à un ensemble d’espèces de bactéries aérobies Gram positives; pour la grande majorité saprophage, celles-ci se retrouvent dans le sol de nombreux environnements, formant des endospores en conditions défavorables. Si Bacillus cereus Frankland et Frankland et B. anthracis Cohn sont des pathogènes humains redoutés, certaines espèces démontrent un potentiel insecticide remarquable (Prescott et al. Reference Prescott, Harley, Klein, Bacq-Calberg and Dusart2003). C’est notamment le cas de Bacillus thuringiensis, dont les formulations commerciales sont les plus vendues parmi les insecticides biologiques (Lacey Reference Lacey2007). Cette bactérie a la particularité de synthétiser une inclusion cristalline composée de toxines insecticides (les delta-endotoxines) pendant la phase de sporulation. Ces delta-endotoxines comprennent deux familles: les protéines Cry (possédant un haut niveau de spécificité) et Cyt. Suivant les souches, cette bactérie est ainsi utilisée pour le contrôle de Lepidoptera, Diptera et Coleoptera (Schnepf et al. Reference Schnepf, Crickmore, Van Rie, Lereclus, Baum and Feitelson1998; van Frankenhuyzen Reference van Frankenhuyzen2009). Il est à noter que, actuellement, la classification des souches de Bacillus thuringiensis est basée sur le sérotypage des antigènes flagellaires et non le type de delta-endotoxines qu’elles produisent (de Barjac et Frachon Reference de Barjac and Frachon1990).
Bacillus thuringiensis var. israelensis
C’est en 1976 que Goldberg et Margalit (Reference Goldberg and Margalit1977) isolèrent en Israël la bactérie Bacillus thuringiensis var. israelensis à partir de larves de Culex pipiens Linnaeus. Margalit et Deam (Reference Margalit and Dean1985) établirent la sensibilité de nombreuses espèces de moustiques et simulies (Diptera: Simuliidae), et cette liste fut encore augmentée par la suite (Glare et O’Callaghan Reference Glare and O’Callaghan1998; Boisvert et Boisvert Reference Boisvert and Boisvert2000). Cependant, le spectre d’activité de cette bactérie demeure restreint principalement au sous-ordre des Nématocères Culicomorphes. Son innocuité vis-à-vis d’autres organismes, y compris l’homme, est prouvée: l’ingestion sous quelque forme que ce soit est sans danger (Boisvert et Boisvert Reference Boisvert and Boisvert2000).
Cette spécificité de l’effet toxique fut d’un intérêt majeur et la bactérie (sérotype H-14) est aujourd’hui à la base de produits commerciaux largement répandus (Lacey Reference Lacey2007). Comment l’expliquer? Il faut savoir que l’effet larvicide de la bactérie provient notamment du cristal formé lors de la sporulation (Aronson et Shai Reference Aronson and Shai2001; Bravo et al. Reference Bravo, Gill and Soberon2007; Soberon et al. Reference Soberon, Fernandez, Perez, Gill and Bravo2007; Otieno-Ayayo et al. Reference Otieno-Ayayo, Zaritsky, Wirth, Manasherob, Khasdan, Cahan and Ben-Dov2008; Bravo et al. Reference Bravo, Likitvivatanavong, Gill and Soberon2011; Fig. 1, extraite de Federici et al. Reference Federici, Park, Bideshi, Wirth and Johnson2003). Quatre étapes sont requises. (1) Tout d’abord, il est nécessaire que l’insecte puisse ingérer ces cristaux. (2) Ceux-ci doivent ensuite être dissout par le pH alcalin du mésentéron de la larve, libérant les précurseurs de toxines protéiques: les protoxines (ou delta-endotoxines). (3) Le clivage des régions N- et/ou C-terminales des protoxines par des protéases permet de générer quatre toxines actives: Cry4A, Cry4B, Cry11A et Cyt1A. (4) Ces toxines agissent en synergie et détruisent l’épithélium intestinal: elles se fixent spécifiquement à un récepteur membranaire à la surface des cellules épithéliales du mésentéron, et leur oligomérisation conduit à la formation de pores dans la membrane plasmique permettant ainsi l’entrée d’ions dans la cellule atteinte. Le potentiel transmembranaire détruit, une lyse cellulaire osmotique s’ensuit. Le tube digestif s’en retrouve ainsi perforé et paralysé, et la mort de l’insecte survient dans les 24 à 48 heures. Ce serait ainsi la capacité de l’organisme à activer les toxines et la présence/absence de récepteurs membranaires propres à celles-ci qui conditionnerait en grande partie la spécificité du potentiel létal de la bactérie envers les espèces cibles. Une fois le tube digestif perforé, les spores bactériennes peuvent germer et proliférer dans l’hémolymphe, résultant en une septicémie.

Fig. 1 (A) Cellule sporulante de Bacillus thuringiensis var. israelensis et (B) inclusion cristalline montrant les toxines individuelles qui la composent (Cry4A, Cry4B, Cry11A, Cyt1A). Sp=spore; E=exosporium; PB=inclusion cristalline. Extraite de Federici et al. (Reference Federici, Park, Bideshi, Wirth and Johnson2003).
Bacillus sphaericus
Bacillus sphaericus est une autre Bacillaceae commercialisée sous forme de biopesticide (Lacey Reference Lacey2007). La première souche pathogène vis-à-vis des moustiques fut découverte en 1965 mais démontra un faible pouvoir de contrôle; de nombreuses autres souches bien plus intéressantes furent découvertes par la suite, parmi lesquelles les souches 1593 (Wickremesinghe et Mendis Reference Wickremesinghe and Mendis1980) et 2362 (Weiser Reference Weiser1984) appartenant au sérotype flagellaire H5a5b. À la différence de Bacillus thuringiensis var. israelensis, cette bactérie produit une toxine unique (Bin) lors de la sporulation (Baumann et al. Reference Baumann, Clark, Baumann and Broadwell1991; Charles et al. Reference Charles, Nielsen-LeRoux and Delécluse1996; Park et al. Reference Park, Bideshi and Federici2010; Berry Reference Berry2012). Cette toxine est composée de deux sous-unités (BinA et BinB), produites en concentration équimolaire, qui co-cristallisent en un corps parasporal (Fig. 2, extraite de Park et al. Reference Park, Bideshi and Federici2010). La spore bactérienne ingérée, les protéines BinA et BinB sont libérées sous pH alcalin et clivées par des protéases. Les peptides qui en résultent constituent la toxine active (Lacey Reference Lacey2007; Berry Reference Berry2012). BinB représente le domaine de liaison et détermine la spécificité à l’hôte: il lie spécifiquement une α-glucosidase à la surface des microvillosités des cellules épithéliales intestinales. BinA représente quant à lui le domaine toxique et procède à la formation de pores dans les membranes ciblées. Ainsi, BinB ne peut entraîner de toxicité seule, tandis que BinA requiert cette dernière pour une activité optimale. Enfin, il est à noter également que plusieurs souches de Bacillus sphaericus ont la capacité de produire des toxines Mtx dirigées exclusivement contre les moustiques (Park et al. Reference Park, Bideshi and Federici2010). Cependant, ces toxines ne se rencontrent pas dans les spores bactériennes: elles sont exclusivement produites durant la phase végétative et ne cristallisent pas. De plus, une fois ingérées, elles sont rapidement dégradées par des protéases cellulaires. En conséquence, leur contribution à l’effet larvicide demeure limitée.
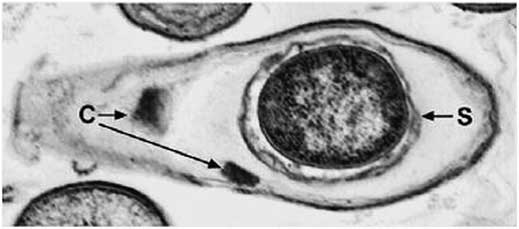
Fig. 2 Vue en microscopie électronique d’une cellule sporulante de Bacillus sphaericus 2362. C=corps parasporal; S=spore. Extraite de Park et al. (Reference Park, Bideshi and Federici2010).
Potentiel biopesticide
Si le potentiel larvicide de ces bactéries a pu être exploité avec succès (Becker Reference Becker1997), c’est dû en grande partie à leur capacité d’être aisément cultivées sur un milieu artificiel. Les bactéries sont produites par fermentation puis amenées à sporuler. Les cristaux sont récupérés et conditionnés sous quatre principales formes de produits commerciaux: poudres, granules, briquettes ou liquides. Le choix dépend de l’insecte ciblé, du milieu à traiter et de la persistance de l’effet toxique désirée. Cependant, si la bactérie ne produit qu’une seule spore à l’extrémité de la cellule et un seul cristal à l’autre, il n’y a pas de lien entre la quantité de toxines contenues dans les cristaux et le nombre de spores bactériennes présentes dans une formulation. C’est pour cette raison que le potentiel larvicide d’une formulation est exprimé sous forme d’Unité Internationale Toxique (UIT) par unité de poids (Boisvert et Boisvert Reference Boisvert and Boisvert2000).
Tant Bacillus thuringiensis var. israelensis que Bacillus sphaericus induisent une mortalité larvaire dans les 24 à 48 heures suivant l’ingestion et peuvent être utilisés simultanément avec d’autres agents de contrôle. Cependant, ces deux bactéries présentent un spectre d’action différent. C’est en effet l’interaction entre les différentes toxines et leur récepteur respectif qui détermine la gamme d’hôtes potentiels. Bien que la susceptibilité d’un insecte puisse varier au sein d’un même genre suivant la souche bactérienne testée, il est généralement admis que les toxines de Bacillus thuringiensis var. israelensis sont actives tant contre les larves de moustiques appartenant aux genres Culex et Aedes (mais peu contre Anopheles) que de simulies (Balaraman et al. Reference Balaraman, Balasubramanian and Manonmani1983; Charles et Nielsen-LeRoux Reference Charles and Nielsen-LeRoux1996). Quatre produits ont ainsi été commercialisés dans plusieurs pays pour le contrôle de moustiques et de simulies, dont deux (sérotype H-14) se sont révélés être des outils importants dans les programmes de lutte: VectoBac® et Teknar® (Valent BioSciences, Libertyville, Illinois, États-Unis d’Amérique). Au contraire, le spectre d’activité de Bacillus sphaericus est uniquement restreint aux moustiques et, d’une manière générale, ses toxines sont reconnues comme étant hautement pathogènes pour beaucoup d’espèces d’Anopheles et de Culex, mais ne permet d’atteindre que des espèces d’Aedes d’intérêt marginal (Charles et Nielsen-LeRoux Reference Charles and Nielsen-LeRoux1996). Cette bactérie a de plus l’avantage d’être plus efficace en eau polluée. Un seul produit, basé sur la souche 2362, a été commercialisé: VectoLex® (Valent BioSciences, Libertyville, Illinois, États-Unis d’Amérique).
Malgré son utilisation intensive dans de nombreux écosystèmes, aucun cas de résistance n’a été observé vis-à-vis de Bacillus thuringiensis var. israelensis. Ceci s’explique par la diversité des toxines auxquelles sont soumises les populations ciblées (Likitvivatanavong et al. Reference Likitvivatanavong, Chen, Evans, Bravo, Soberon and Gill2011). Cependant, des cas de résistances ont pu être induits en laboratoire (Charles et Nielsen-LeRoux Reference Charles and Nielsen-LeRoux2000, Paris et al. Reference Paris, Tetreau, Laurent, Lelu, Després and David2011), suggérant un manque de sensibilité des outils diagnostics (Tetreau et al. Reference Tetreau, Stalinski, David and Després2013b). Le constat est plus alarmant dans le cas de Bacillus sphaericus: la toxine Bin agissant sur un récepteur bien défini, son utilisation en tant que composé principal dans les produits commerciaux a conduit à l’apparition de résistances dans les populations de moustiques en conditions de terrain dans plusieurs pays (Charles et al. Reference Charles, Nielsen-LeRoux and Delécluse1996; Nielsen-LeRoux et al. Reference Nielsen-LeRoux, Pasteur, Prètre, Charles, Ben Sheikh and Chevillon2002; Park et al. Reference Park, Bideshi and Federici2010). L’utilisation à long terme est donc remise en question. Afin de gérer ces apparitions, il serait nécessaire de pratiquer une rotation des traitements à base de Bacillus thuringiensis var. israelensis et Bacillus sphaericus, ou encore d’utiliser simultanément les deux (VectoMax®) (Charles et Nielsen-LeRoux Reference Charles and Nielsen-LeRoux1996; Park et al. Reference Park, Bideshi and Federici2010). Une autre possibilité serait de promouvoir le développement de souches recombinantes, c’est-à-dire modifiées génétiquement par l’introduction de nouveaux gènes, afin d’en augmenter l’efficacité. Il s’agirait ainsi d’allier les différentes toxines de Bacillus thuringiensis var. israelensis, Bacillus sphaericus ou toute autre souche d’intérêt en une seule bactérie: par leurs modes d’action différents, la résistance à l’une de ces toxines peut être palliée par les autres. Il est en effet plus difficile pour un insecte de développer une résistance simultanément contre plusieurs toxines plutôt qu’une seule (Federici et al. Reference Federici, Park, Bideshi, Wirth and Johnson2003; Federici Reference Federici2010). Il est par exemple établi que Cyt1A a la capacité d’entrer en synergie non seulement avec les endotoxines de Bacillus thuringiensis var. israelensis mais aussi avec la toxine Bin de Bacillus sphaericus, permettant alors de supprimer toute résistance envers cette dernière (Wirth et al. Reference Wirth, Walton and Federici2000). Cependant, l’utilisation de bactéries génétiquement modifiées dans l’environnement pose à nouveau des problèmes d’ordre éthique et légal.
Les virus entomopathogènes
Diversité
Les souches virales entomopathogènes connues se répartissent au sein d’au moins sept familles: Baculoviridae, Iridoviridae, Poxviridae, Reoviridae, Parvoviridae, Picornaviridae et Rhabdoviridae (Prescott et al. Reference Prescott, Harley, Klein, Bacq-Calberg and Dusart2003). Ces virus entomopathogènes peuvent être répartis au sein de deux grands groupes distincts: occlus et non-occlus (Becnel Reference Becnel2006; Becnel et White Reference Becnel and White2007; Tableau 4). Un virus est dit occlus lorsque les particules virales nouvellement produites sont enchâssées dans une matrice protéique cristalline (ou corps d’occlusion) de forme tridimensionnelle variant selon les espèces. Ce sont notamment, dans le cas des moustiques, des virus de la polyédrose nucléaire (Baculoviridae), des virus de la polyédrose cytoplasmique (Reoviridae) et des Entomopoxvirus (Poxviridae) (Becnel Reference Becnel2006; Becnel et White Reference Becnel and White2007). Au contraire, les particules virales nouvellement produites des virus non-occlus ne forment que de simples agrégats (réseaux) intracellulaires (ou corps d’inclusions paracristallins) et ne possèdent pas de corps d’occlusion. Ce sont notamment (toujours dans le cas des moustiques) des virus iridescents (Iridoviridae) et des virus de la densonucléose (Parvoviridae) (Becnel Reference Becnel2006; Becnel et White Reference Becnel and White2007). C’est à ces derniers que cette section sera consacrée.
Tableau 4 Principaux groupes de virus affectant les moustiques (d’après Becnel Reference Becnel2006; Becnel et White Reference Becnel and White2007).

De nombreux virus de la densonucléose sont désormais connus pour infecter différentes espèces d’insectes réparties dans cinq ordres (Lepidoptera, Diptera, Orthoptera, Dictyoptera, Odonata) et même certains crustacés (Bergoin et Tijssen Reference Bergoin and Tijssen2000). Les virus de la densonucléose du moustique (mosquito densonucleosis viruses, MDV) appartiennent aux genres Brevidensovirus et Densovirus. Ces virus se répliquent dans le noyau de cellules de moustiques et y provoquent une hypertrophie (densonucléose) caractéristique à laquelle ils doivent leur nom. Les différentes souches sont nommées d’après l’espèce de moustique à partir de laquelle elles ont été isolées, souvent à partir d’un criblage en culture cellulaire. Cette désignation ne reflète donc pas nécessairement une spécificité de la souche virale (Carlson et al. Reference Carlson, Suchman and Buchatsky2006). Le premier MDV fut isolé en Russie à partir d’une colonie de laboratoire d’Aedes aegypti et baptisé AaeDNV (Lebedeva et al. Reference Lebedeva, Zelenko, Kuznetsova and Gudzgorban1972). Un second (AalDNV) fut isolé près de vingt ans plus tard à partir d’une culture cellulaire d’Aedes albopictus (Jousset et al. Reference Jousset, Barreau, Boublik and Cornet1993), et de nombreuses autres souches furent mises en évidence dans les années qui suivirent.
Les virus de la densonucléose du moustique
Les virus sont des parasites intracellulaires obligatoires qui utilisent la machinerie cellulaire pour se répliquer; les virions nouvellement produits mènent souvent à la lyse de cette cellule et à la mort de l’organisme hôte (Prescott et al. Reference Prescott, Harley, Klein, Bacq-Calberg and Dusart2003). Une particule virale de MDV (Fig. 3, d’après Carlson et al. Reference Carlson, Suchman and Buchatsky2006) d’environ 20 nm de diamètre, consiste en une nucléocapside icosaédrique dépourvue d’enveloppe (Fig. 3A). Le génome se compose de molécules d’ADN simple brin linéaires; celles-ci codent pour des protéines structurales de capside (VP1 et VP2) et des protéines non-structurales (NS1 et NS2) (Carlson et al. Reference Carlson, Suchman and Buchatsky2006). Les papilles anales des larves constituent le site d’infection primaire. La réplication a lieu dans le noyau des cellules infectées (Fig. 3B) et le brin sens négatif (c’est-à-dire complémentaire à l’ARNm) est repris pour former les virions. Ceux-ci s’agrègent sous formes d’inclusions paracristallines au sein même de la cellule infectée (Fig. 3C). Les particules virales gagnent ensuite les corps gras puis la plupart des autres tissus (notamment l’hypoderme, le système nerveux et les muscles) (Becnel et White Reference Becnel and White2007). Une partie des virions nouvellement formés sont excrétés dans l’environnement (Fig. 4, d’après Carlson et al. Reference Carlson, Suchman and Buchatsky2006); une transmission horizontale du virus (c’est-à-dire d’une larve à l’autre) tant intra- qu’interspécifique est ainsi possible. À partir de là, deux issues sont reconnues: soit la larve infectée meurt, soit elle parvient à se nymphoser et devenir adulte. Les adultes issus de larves infectées ont une durée de vie et une fécondité amoindries; les femelles sont également capables de transmettre le virus à la descendance (transmission verticale) et peuvent ainsi le disséminer d’un site de ponte à l’autre (Carlson et al. Reference Carlson, Suchman and Buchatsky2006). Enfin, les MDV ne semblent pas capables de se répliquer au sein de vertébrés: ces virus ciblent spécifiquement les moustiques (et même, certaines espèces) par des mécanismes d’infection et de réplication précis. Par exemple, AeDNV est connu pour infecter les genres Aedes, Culex et Culiseta Felt mais aucun cas évident n’a été reporté pour Anopheles (Carlson et al. Reference Carlson, Suchman and Buchatsky2006).
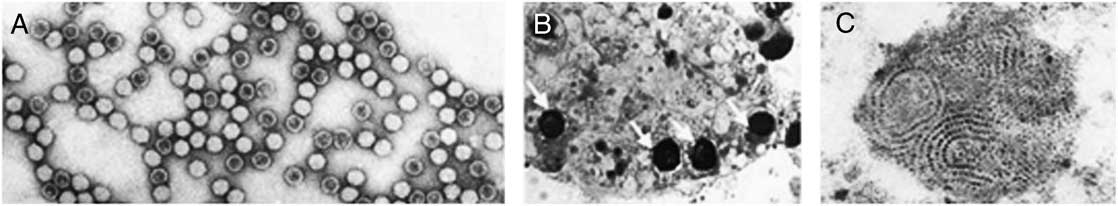
Fig. 3 Vue en microscopie électronique de l’AaeDNV dans une larve d’Aedes aegypti infectée. (A) Particules virales d’AaeDNV. (B) Noyaux hypertrophiés (flèches) dans un corps gras. (C) Réseaux intracellulaires de virions. D’après Carlson et al. (Reference Carlson, Suchman and Buchatsky2006).
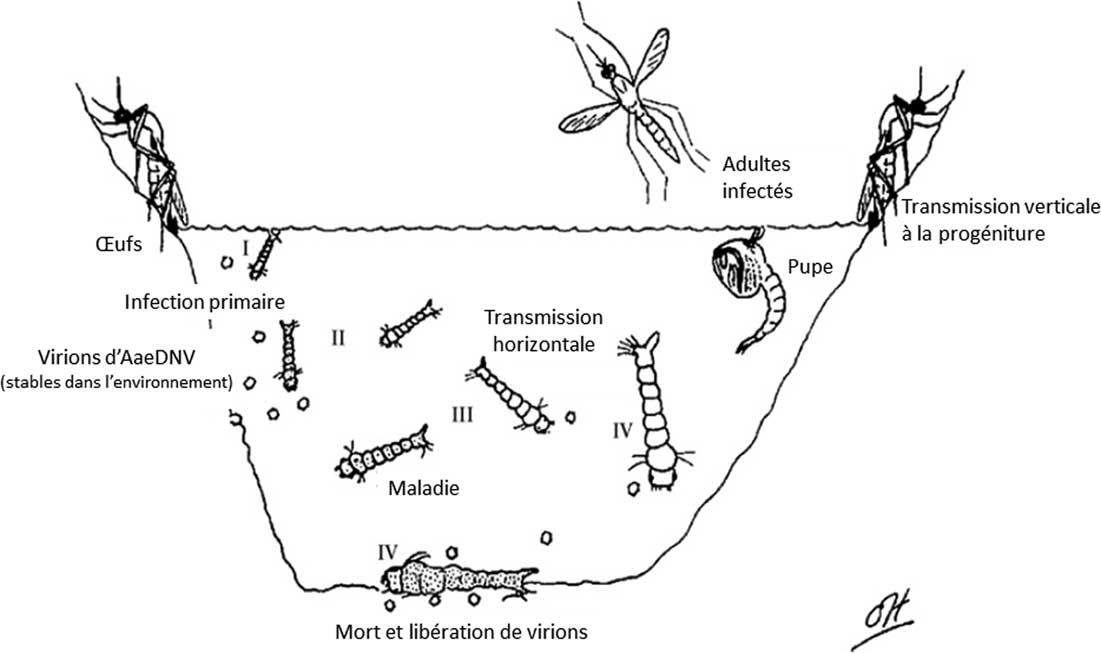
Fig. 4 Cycle d’un virus de la densonucléose du moustique. D’après Carlson et al. (Reference Carlson, Suchman and Buchatsky2006).
Potentiel biopesticide
Les potentialités des MDV dans le contrôle des moustiques sont discutées dans Becnel et White (Reference Becnel and White2007). Leur relative stabilité dans l’environnement et leur mode d’action spécifique font des MDV des agents microbiens de grand intérêt pour les programmes de lutte intégrée. De plus, les possibilités de transmission verticale de ces virus permettraient d’atteindre les sites de ponte isolés et temporaires (pneus, canettes,…) d’ordinaire difficiles à traiter. Il serait également possible de modifier une souche virale pour en exacerber certaines caractéristiques d’intérêt (persistance, toxicité,…). Cependant, la production de particules virales représente la contrainte majeure de ces agents. À ce jour, une seule préparation (Viroden, basée sur l’AaeDNV) destinée au contrôle des moustiques fut développée. Ce produit s’est révélé efficace contre les larves d’Aedes aegypti: les populations soumises en conditions de terrain se sont vues réduites d’environ 77% (Buchatsky et al. Reference Buchatsky, Kuznetsova, Lehedinets and Konoko1987). De plus, son mode d’action spécifique le rendait sans danger pour les organismes à sang chaud (Vasil’eva et al. (Reference Vasil’eva, Lebedinets, Gurval’, Chigir’, Buchatskii and Kuznetsova1990) cité par Becnel et White (Reference Becnel and White2007)). Bien que prometteur, les difficultés de production massive expliquent que le Viroden n’a jamais été testé à grande échelle. Ainsi, pour pouvoir utiliser de façon rentable les virus comme agents de contrôle, il est besoin d’affiner les méthodes de production (Becnel et White Reference Becnel and White2007). Actuellement, le développement de cultures continues de cellules C6/36 d’Aedes albopictus adaptées à une culture SFPFM ouvre des nouvelles perspectives. Ce procédé permet la production de grandes quantités de virus à bien moindre coût (Suchman et Carlson Reference Suchman and Carlson2004). À cela peut s’ajouter une méthode de purification de MDV à large échelle au moyen de membranes échangeuses d’ions (Specht et al. Reference Specht, Han, Wickramasinghe, Carlson, Czermak, Wolf and Reif2004; Han et al. Reference Han, Specht, Wickramasinghe and Carlson2005).
Il est enfin à noter que cette stabilité et cette spécificité permettent d’utiliser les MDV en tant que vecteurs de transfert de gènes dans les larves de moustiques. Le processus peut être amplifié par la transmission horizontale des particules virales. Les MDV pourraient ainsi être utilisés comme outils de contrôle génétique: ils permettraient d’immuniser une population de moustiques vis-à-vis d’un pathogène d’importance médicale ou vétérinaire, ou du moins d’en réduire le potentiel vecteur (Carlson et al. Reference Carlson, Suchman and Buchatsky2006; Gu et al. Reference Gu, Liu, Deng, Peng and Chen2011). Dans le même ordre d’idée, certains auteurs vont jusqu’à imaginer utiliser les virus pour sensibiliser les moustiques aux insecticides: ceci permettrait de diminuer les doses employées et d’augmenter l’efficacité des traitements (Lapied et al. Reference Lapied, Pennetier, Apaire-Marchais, Licznar and Corbel2009).
Les champignons entomopathogènes
Diversité
De 700 à 800 espèces de champignons auraient été reconnues comme pathogènes d’insectes et/ou d’acariens (Regnault-Roger Reference Regnault-Roger2005). Leur répartition taxonomique est variée: Ascomycètes, Chytridiomycètes, Oomycètes (anciennement rattachés aux champignons), ou encore Zygomycètes. Le système de classification adopté, en constante évolution, sera celui de Kirk et al. (Reference Kirk, Cannon, Minter and Stalpers2008) (http://www.speciesfungorum.org/).
Dans la recherche d’alternatives aux insecticides, il n’est pas surprenant qu’un intérêt certain se soit également porté sur les champignons entomopathogènes. Les espèces utilisées en recherche appartiennent pour la plupart aux groupes des Zygomycètes (et plus particulièrement à l’ordre des Entomophthorales) et des Ascomycètes (notamment de l’ordre des Hypocreales) (Shah et Pell Reference Shah and Pell2003; Charnley et Collins Reference Charnley and Collins2007). Certaines espèces sont désormais utilisées principalement en agriculture; malheureusement, l’emploi de ces champignons en lutte anti-vectorielle rencontre moins de succès. Scholte et al. (Reference Scholte, Knols, Samson and Takken2004) résument de façon remarquable les recherches de ces dernières décennies sur le contrôle des moustiques par des isolats fongiques et met plus particulièrement l’accent sur les genres Lagenidium Schenk (Oomycota), Coelomomyces Keilin (Chytridiomycota), Entomophthora Krenner (Zygomycota Entomophthorales), Culicinomyces Couch (Ascomycota Hypocreales), Beauveria Vuillemin (Ascomycota Hypocreales) et Metarhizium Sorokin (Ascomycota Hypocreales) (Tableau 5). Puisque les espèces de champignons ciblées pour le développement de myco-insecticides dans le contrôle des moustiques sont pour la plupart des Hypocreales (Butt et al. Reference Butt, Jackson and Magan2001), cette section sera principalement axée sur ceux-ci. Davantage d’informations sur la biologie et les voies d’infection des autres groupes de champignons sont données par Shah et Pell (Reference Shah and Pell2003), Scholte et al. (Reference Scholte, Knols, Samson and Takken2004), Charnley et Collins (Reference Charnley and Collins2007).
Tableau 5 Principaux groupes de champignons affectant les moustiques, et espèces d’intérêt illustrant les genres concernés (d’après Scholte et al. Reference Scholte, Knols, Samson and Takken2004; classification d’après Kirk et al. Reference Kirk, Cannon, Minter and Stalpers2008).
Les Hypocreales
Une large présentation de la biologie des Hypocreales et des aspects biochimiques liés au processus infectieux est donnée par Shah et Pell (Reference Shah and Pell2003) et Khachatourians et Qazi (Reference Khachatourians and Qazi2008). Les conidies (ou spores) de ces champignons filamenteux, issues d’une reproduction asexuée, sont généralement responsables de l’infection et sont dispersées passivement dans l’environnement depuis le cadavre d’un insecte. Bien que l’ingestion des conidies par un nouvel hôte et l’invasion de celui-ci à partir de son système digestif soit possible, la voie d’infection se fait généralement au travers du tégument externe. Ainsi, lorsque ces conidies entrent en contact avec la cuticule d’un nouvel insecte hôte, l’infection est initiée en quatre phases majeures. (1) La nature hydrophobe des conidies est principalement responsable de leur adhésion à la cuticule (interactions hydrophobes). Une fois celles-ci attirées, des systèmes de reconnaissance spécifiques (p.ex. lectines) peuvent renforcer l’attachement par des substances mucilagineuses adhésives et faciliter la germination. (2) La germination des conidies est dépendante des conditions de l’environnement et de la nature (composition chimique) de l’hôte. Celles-ci doivent être hydratées pour germer, et la croissance du tube germinal est associée à la production d’enzymes hydrolytiques extracellulaires (protéases et peptidases, chitinases, lipases et lipoxygénases) destinées à exploiter les molécules dérivées de l’hôte. Ces molécules serviront ainsi en tant que source d’énergie et pour la synthèse de macromolécules. (3) La phase de différenciation est caractérisée par la production d’appressoria (points d’ancrage) sur la surface cuticulaire. (4) La pénétration de la cuticule par le filament infectieux est permise par une pression tant mécanique qu’enzymatique. Celui-ci aboutit dans l’hémocoele; il y procède à une croissance et une multiplication menant à la production de corps hyphaux. Ces derniers envahissent les tissus de l’hôte et produisent des métabolites toxiques qui interfèrent avec les mécanismes de défense immunitaire. À la mort de l’insecte infecté, le champignon émerge du corps et procède à la sporulation (ou conidiogenèse): les conidies nouvellement produites sont dispersées dans l’environnement. Les champignons Hypocreales peuvent également former des structures d’hivernation basées sur des hyphes comprimées (sclerotia) ou des spores persistantes à paroi épaisse (chlamydospores).
Potentiel biopesticide
Certains champignons peuvent être produits massivement et conditionnés sous forme de suspensions aqueuses de spores pour être ensuite vaporisés, parfois en combinaison avec des matériaux synthétiques destinés à augmenter leur persistance ou leur pouvoir infectieux. Suivant les souches, la persistance au sein de la population d’insectes ciblée permet de restreindre les applications dans l’environnement (Shah et Pell Reference Shah and Pell2003). L’avantage majeur des champignons entomopathogènes est que, contrairement aux autres agents microbiens, ils ont la capacité d’infecter leur hôte par la voie transcutanée et ne nécessitent pas d’être ingérés par ce dernier. Ainsi, tous les stades de développement (œufs, larves, nymphes, adultes) peuvent être infectés. Ils représentent de ce fait un grand intérêt en agriculture dans la lutte contre les insectes piqueurs-suceurs tels que les pucerons, les aleurodes ou les thrips (Regnault-Roger Reference Regnault-Roger2005). Le spectre d’hôtes (moustiques ou autres) est généralement plus large que celui des autres micro-organismes entomopathogènes; cependant, un certain degré de sélectivité peut être distingué suivant les isolats fongiques et laisse entrevoir un potentiel de contrôle envers différentes gammes d’insectes (Regnault-Roger Reference Regnault-Roger2005). Enfin, bien que les insectes puissent s’adapter et réduire l’infection (production de toxines antifongiques, mélanisation, mue accélérée), il est à noter qu’aucun cas de résistance n’aurait été signalé. Ceci pourrait s’expliquer par le fait que le processus infectieux implique la sécrétion d’une large gamme d’enzymes et de toxines (Kanzok et Jacobs-Lorena Reference Kanzok and Jacobs-Lorena2006). Plusieurs souches de champignons produisent d’ailleurs des métabolites secondaires dont certains démontrent un pouvoir toxique intéressant, et qui pourraient être valorisés en tant que biopesticides à part entière (Butt et Copping Reference Butt and Copping2000).
Il est cependant reproché aux champignons leur action lente sur les populations d’insectes ciblées en raison du délai de germination et de pénétration des filaments dans l’hémocoele. Un biopesticide basé sur des spores de champignon entomopathogène ne sera efficace qu’après 2 à 5 jours d’exposition (parfois davantage), alors qu’un insecticide de synthèse ne mettra que 24 à 48 heures pour un même résultat (Thomas et Read Reference Thomas and Read2007; Pereira et al. Reference Pereira, de Paula, Gomes, Pedra and Samuels2009; Blanford et al. Reference Blanford, Shi, Christian, Marden, Koekemoer and Brooke2011). Ceci traduit la nécessité de caractériser les enzymes et métabolites impliqués dans leur pathogénicité, et d’isoler les souches les plus virulentes. De plus, les performances réalisées en laboratoire ne sont que rarement répétées sur le terrain et un même isolat fongique ne peut convenir qu’à une région particulière. Ceci s’explique par le fait que de nombreuses souches sont très dépendantes des conditions de l’environnement (température, humidité, rayons UV), mais aussi qu’une perte de pouvoir infectieux est souvent observée lors de la culture en milieu artificiel. La viabilité des conidies constitue un vrai défi. Ainsi, afin d’être capable de transposer les résultats de laboratoire sur le terrain, il est important de mettre au point les conditions de culture, de stockage et de conditionnement qui permettent de préserver ce pouvoir infectieux (Butt et Copping Reference Butt and Copping2000).
Plusieurs préparations fongiques sont proposées pour lutter contre des insectes nuisibles en agriculture; c’est par exemple le cas de Verticillium lecanii Viegas (Vertalec®, Koppert, Berkel en Rodenrijs, Pays-Bas), Paecilomyces fumosoroseus (Wize) Brown et Smith (PreFeRal®, Biobest, Westerlo, Belgique) ou encore Beauveria bassiana (Balsamo-Crivelli) Vuillemin (Naturalis®, Troy Biosciences, Phoenix, Arizona, Etats-Unis d’Amérique) destinés à lutter contre les pucerons et autres ravageurs apparentés (aleurodes, thrips) en Europe (Regnault-Roger Reference Regnault-Roger2005). Citons encore l’exemple de Metarhizium anisopliae (Metschnikoff) Sorokin var. acridum récemment approuvé dans la lutte contre les criquets locustes et les sauterelles en Afrique, dont une production massive de conidies a pu être réalisée à partir d’une simple culture à base de riz (Mendonça Reference Mendonça1992). Par contre, peu de préparations fongiques ont été proposées en lutte anti-vectorielle. Dans le cas des moustiques, un seul produit basé sur Lagenidium giganteum Couch fut commercialisé (Laginex®, AgraQuest, Davis, California, États-Unis d’Amérique) pour lutter notamment contre les espèces de Culex aux États-Unis d’Amérique (Scholte et al. Reference Scholte, Knols, Samson and Takken2004, Kerwin Reference Kerwin2007). Laginex avait l’avantage par rapport au Bacillus thuringiensis var. israelensis de persister en eau stagnante, permettant ainsi d’infecter plusieurs générations de moustiques. Un contrôle total de larves de Culex quinquefasciatus pouvait être assuré jusqu’à 20 jours après l’application du produit, en comparaison d’une formulation de Vectobac 12AS, qui nécessite un nouveau traitement après 10 jours (Hallmon et al. Reference Hallmon, Schreiber, Vo and Bloomquist2000). Cependant, Laginex ne fut commercialisé qu’entre 1997 et 1999: son manque de stabilité et sa durée de vie limitée par rapport aux insecticides chimiques (problèmes d’hydratation du mycélium, de survie des zoospores limitée à 48 heures, de sensibilité à la température, et de contamination) du fait de l’absence de forme de résistance du champignon furent des contraintes majeures.
Scholte et al. (Reference Scholte, Knols, Samson and Takken2004) discutent des potentialités offertes par les champignons entomopathogènes dans le contrôle des moustiques. Les champignons entomopathogènes naturellement associés aux moustiques appartiennent principalement aux Entomophthorales, mais la plupart de ces espèces (dont le genre Entomophthora) ne peuvent croître en fermentation: leur production massive est difficile. Dès lors, bien qu’ils ne soient pas spécifiquement adaptés aux moustiques, l’intérêt s’est porté sur les autres groupes. Certaines espèces y sont particulièrement intéressantes, mais aucune ne possède toutes les propriétés requises pour un contrôle efficace et de faible coût. Un champignon entomopathogène peut se révéler avantageux par rapport à Bacillus thuringiensis var. israelensis et Bacillus sphaericus notamment grâce à sa capacité d’infecter tous les stades. Idéalement, l’isolat fongique devrait donc se révéler pathogène tant vis-à-vis des stades larvaires qu’adultes et démontrer une bonne spécificité aux espèces ciblées. De par sa biologie, il serait intéressant qu’il puisse également être dispersé activement par les femelles adultes d’un site d’oviposition à l’autre. En effet, aucun transport de Bacillus thuringiensis var. israelensis ou de Bacillus sphaericus n’est assuré d’un site à l’autre alors que les habitats larvaires des espèces vectrices les plus importantes sont temporaires et difficiles à traiter dans leur intégralité. Ainsi, la plupart des souches de Lagenidium, Coelomomyces et Culicinomyces ciblent les stades larvaires de moustiques et n’infectent pas les adultes: la dispersion au travers des habitats n’est que trop limitée. Une production massive rentable de ces champignons semble également difficile à assurer. Par contre, bien que de spectre plus large, Beauveria bassiana et Metarhizium anisopliae tuent tant les adultes que les larves en conditions de laboratoire et les nombreuses formulations commerciales déjà disponibles contre d’autres insectes prouvent qu’ils peuvent être produits massivement de façon rentable. Ces deux champignons sont considérés par de nombreux auteurs comme ayant un haut potentiel de contrôle de moustiques vecteurs (Alves et al. Reference Alves, Alves, Lopes, Pereira and Vieira2002; Scholte et al. Reference Scholte, Knols, Samson and Takken2004; Kanzok et Jacobs-Lorena Reference Kanzok and Jacobs-Lorena2006; Pereira et al. Reference Pereira, de Paula, Gomes, Pedra and Samuels2009; Blanford et al. Reference Blanford, Shi, Christian, Marden, Koekemoer and Brooke2011; Lynch et al. Reference Lynch, Grimm, Thomas and Read2012; Seye et al. Reference Seye, Ndiaye, Faye and Afoutou2012, Reference Seye, Ndione, Touré, Ndiaye, Boukraa and Bawin2013). Récemment, le pouvoir pathogène d’une souche d’Aspergillus clavatus Desmazières envers des larves d’Aedes aegypti, Anopheles gambiae Giles et Culex quinquefasciatus suggère que ce champignon pourrait également être utilisé dans le contrôle de populations de moustiques (Seye et Ndiaye Reference Seye and Ndiaye2008; Seye et al. Reference Seye, Faye, Ndiaye, Njie and Afoutou2009).
Metarhizium anisopliae compte parmi les champignons entomopathogènes les mieux caractérisés dans la littérature scientifique. Cette espèce possède un spectre d’hôtes large incluant plusieurs arachnides et pas moins de 200 espèces d’insectes réparties dans cinq ordres différents (Scholte et al. Reference Scholte, Knols, Samson and Takken2004). La sécrétion de diverses enzymes (protéases, chitinases, lipases) et métabolites (destruxines) reconnus comme facteurs de virulence a été mise en évidence (Schrank et Vainstein Reference Schrank and Vainstein2010; Liu et Tzeng Reference Liu and Tzeng2012). Suivant les souches, ces composés auraient une sélectivité plus ou moins prononcée vis-à-vis de taxons d’insectes spécifiques (Bagga et al. Reference Bagga, Hu, Screen and St Leger2004). Ce champignon aurait ainsi très peu d’impact sur les vertébrés (dont l’homme) et l’environnement (Zimmermann Reference Zimmermann2007). Bien que les moustiques ne figurent pas parmi les hôtes naturels de ce champignon, plusieurs études de laboratoire ont montré son potentiel en tant qu’agent de contrôle de nombreuses espèces (adultes ou larves) appartenant aux genres Aedes, Culex et Anopheles. Par exemple, Alves et al. (Reference Alves, Alves, Lopes, Pereira and Vieira2002) ont montré des CL50 de 1,97×104 et 3,01×105 conidies/ml de deux souches de Metarhizium anisopliae contre des larves de Culex quinquefasciatus, tandis que Pereira et al. (Reference Pereira, de Paula, Gomes, Pedra and Samuels2009) ont montré une CL50 de 3,16×105 conidies/ml contre des larves d’Aedes aegypti. Scholte et al. (Reference Scholte, Takken and Knols2003) ont quant à eux montré la pathogénicité d’une souche contre des adultes Anopheles gambiae et Culex quinquefasciatus.
Perspectives de lutte anti-vectorielle
Gestion intégrée et contrôle biologique
L’éradication complète de chaque espèce de moustique et des maladies qui lui sont associées fut autrefois l’objectif visé. Néanmoins, cette stratégie s’est souvent révélée irréalisable et rarement viable à long terme (Becker et al. Reference Becker, Petric, Zgomba, Dahl, Boase, Lane and Kaiser2010). Actuellement, la meilleure approche consiste en une gestion (ou lutte) intégrée des populations de moustiques (Lacey et Lacey Reference Lacey and Lacey1990; Sucharit Reference Sucharit1993; Rose Reference Rose2001; Yoda et al. Reference Yoda, Rakue and Mizota2004; Keiser et al. Reference Keiser, Maltese, Erlanger, Bos, Tanner, Singer and Utzinger2005; Beier et al. Reference Beier, Keating, Githure, MacDonald, Impoinvil and Novak2008; Rey et al. Reference Rey, Walton, Wolfe, Roxanne, O’Connell, Berg, Sakolsky-Hoopes and Laderman2012), définie par l’Organisation des Nations Unies pour l’alimentation et l’agriculture (1967) comme un système de gestion des populations d’organismes nuisibles qui met en œuvre toutes les techniques appropriées pour les maintenir à des niveaux inférieurs à ceux causant des dommages d’importance économique et/ou sanitaire. Dans le cadre de la lutte anti-vectorielle, la gestion environnementale et les moyens physiques associés permettent une lutte durable et efficace des populations de moustiques, mais ils ne peuvent suffire à remplacer intégralement les autres méthodes appliquées au contrôle des maladies. Ces stratégies peuvent néanmoins consister en une bonne base en termes de gestion intégrée. En complément, des alternatives plus sécurisantes aux insecticides de synthèse sont requises en raison des effets désastreux engendrés par l’utilisation massive de ces derniers. Le contrôle génétique des moustiques, bien qu’offrant des perspectives intéressantes, a malheureusement montré ses limites en termes d’efficacité, de rentabilité, et de légalité. Il est de plus difficile à mettre en œuvre dans une optique de lutte intégrée. Par contre, le contrôle biologique au travers de l’utilisation de micro-organismes entomopathogènes (ou de produits dérivés) sous forme de biopesticides a déjà été réalisé dans d’autres domaines (Montesinos Reference Montesinos2003; Leng et al. Reference Leng, Zhang, Pan and Zhao2011). Cette approche possède ainsi le potentiel nécessaire pour être développée et valorisée en tant qu’alternative aux insecticides chimiques (ou du moins, en synergie avec ceux-ci) dans le cadre d’une lutte anti-vectorielle intégrée. Un exemple peut être donné par l’utilisation conjointe d’un adulticide chimique (cyperméthrine) et de larvicides biologiques (Bacillus thuringiensis var. israelensis (Vectobac 12AS) et Bacillus sphaericus (Vectolex WG)) pour contrôler les populations du vecteur du paludisme Anopheles balabacensis Baisas en Malaisie (Seleena et al. Reference Seleena, Lee, Chooi and Junaidih2004). De même, l’importation accidentelle de trois espèces invasives de moustiques (Aedes aegypti, Aedes albopictus, et Aedes atropalpus (Coquillett)) via des pneus usés aux Pays-Bas (Scholte et al. Reference Scholte, Den Hartog, Dik, Schoelitsz, Brooks and Schaffner2010) constitue un exemple récent par lequel gestion environnementale, contrôle chimique et biologique sont alliés efficacement en un même programme de gestion. Soulignons encore la production de Bacillus thuringiensis var. israelensis dans un milieu de culture additionné de deltaméthrine capable d’agir en synergie, permettant d’obtenir un insecticide composite à l’activité augmentée (Tetreau et al. Reference Tetreau, Patil, Chandor-Proust, Salunke, Patil and Després2013a).
Les biopesticides face aux insecticides conventionnels
L’application de préparations commerciales de Bacillus demeure le seul exemple concret d’utilisation à succès d’un micro-organisme entomopathogène en lutte anti-vectorielle contre les moustiques. Pourtant, les avantages attendus par rapport aux insecticides conventionnels ne sont pas négligeables (Lacey et al. Reference Lacey, Frutos, Kaya and Vail2001; Glare et al. Reference Glare, Caradus, Gelernter, Jackson, Keyhani and Köhl2012). Outre la diminution des doses d’insecticides utilisées (et des résidus liés) dans l’environnement et l’amélioration consécutive des conditions sanitaires, la sélectivité des agents microbiens devrait favoriser la préservation de la biodiversité. De plus, l’étude de ces micro-organismes et de la diversité de molécules qu’ils produisent permettrait une meilleure gestion des résistances aux composés insecticides au sein des populations de moustiques. Néanmoins, le développement de nouveaux agents microbiens bénéficie de peu d’investissement par rapport aux insecticides de synthèse. En effet, leur utilisation souffre de certains inconvénients (Lacey et al. Reference Lacey, Frutos, Kaya and Vail2001; Glare et al. Reference Glare, Caradus, Gelernter, Jackson, Keyhani and Köhl2012): (1) un spectre d’action généralement trop étroit ou trop large pour être économiquement intéressant, (2) un temps d’action plus long que celui des insecticides chimiques, (3) une efficacité et une persistance souvent limitées par les stress environnementaux, (4) un coût de production excessif, et (5) un temps de stockage souvent réduit. Leur impact en tant qu’agents de lutte anti-vectorielle devra également être évalué à long terme.
Quel avenir pour les biopesticides?
Les moyens de contrôle biologique (dont les biopesticides microbiens) incarnent une gestion des populations d’insectes respectueuse de l’environnement qui cadre avec les courants de pensée de la société occidentale actuelle. L’enjeu n’est donc pas de savoir s’ils parviendront à s’imposer en lutte anti-vectorielle, mais comment. Cependant, le développement de nouveaux produits dépend de la disponibilité en micro-organismes appropriés: moins de 1% des souches isolées auraient le potentiel de devenir un biopesticide à succès (Bailey et Falk Reference Bailey and Falk2011). Les contraintes précitées sont en effet autant d’obstacles. Les futurs agents de contrôle microbien devraient donc faire preuve de virulence, de rapidité d’action et de persistance accrues dans l’environnement. Par ailleurs, bien qu’un spectre d’activité limité puisse contribuer à préserver la biodiversité et l’équilibre sanitaire en termes de santé humaine, les biopesticides ne ciblant que quelques espèces ne possèdent généralement qu’une part limitée du marché (Ravensberg Reference Ravensberg2011; Glare et al. Reference Glare, Caradus, Gelernter, Jackson, Keyhani and Köhl2012). À l’image des produits à base de Bacillus qui visent une gamme d’insectes variée suivant les souches, les nouveaux biopesticides ne pourront s’imposer en lutte anti-vectorielle qu’à partir du moment où ils seront actifs envers un ensemble d’espèces vectrices de Diptera. Ces obstacles ne pourront être surmontés que par une sélection de ces micro-organismes répondant à ces critères (Tranchida et al. Reference Tranchida, Riccillo, Micieli, Garcia and Rodriguero2001; Dhindsa et al. Reference Dhindsa, Sangodkar and Kumar2002; Lopez Lastra et al. Reference Lopez Lastra, Scorsetti, Marti and Garcia2004; Seye et al. Reference Seye, Faye, Ndiaye, Njie and Afoutou2009; Hayes et al. Reference Hayes, Hudon and Park2011), mais aussi au travers du développement de formulations adéquates (Faria et Wraight Reference de Faria and Wraight2007; Seye et Ndiaye Reference Seye and Ndiaye2008; Rosas-Garcia Reference Rosas-Garcia2009; Bukhari et al. Reference Bukhari, Takken and Koenraadt2011; Seye et al. Reference Seye, Ndiaye, Faye and Afoutou2012). Des perspectives intéressantes sont également offertes par les techniques de génie génétique (fusion de protoplastes, induction de mutations ou encore manipulations génétiques) (Federici et al. Reference Federici, Park, Bideshi, Wirth, Johnson, Sakano and Tanq2007; St. Leger et Wang Reference St. Leger and Wang2010), mais le développement et la commercialisation d’un biopesticide basé sur un micro-organisme génétiquement modifié restent délicats du fait des contraintes environnementales, éthiques, et juridiques (Glare et al. Reference Glare, Caradus, Gelernter, Jackson, Keyhani and Köhl2012).
Les composés bioactifs dérivés de micro-organismes entomopathogènes pourraient également être valorisés en tant que biopesticides à part entière, et utilisés seuls ou en synergie avec d’autres moyens de contrôle. Cette approche demeure cependant sous-évaluée en lutte anti-vectorielle. Pourtant, caractériser ces composés et optimiser leur production par des procédés de fermentation en bioréacteurs permettrait le développement à moindre coût de nouveaux biopesticides selon un schéma comparable à celui qui s’opère pour les insecticides de synthèse (Glare et al. Reference Glare, Caradus, Gelernter, Jackson, Keyhani and Köhl2012). Mais par rapport à ces derniers (Srivastava et al. Reference Srivastava, Maurya, Sharma and Mohan2009), les composés bioactifs issus de certaines souches conserveraient leur avantage sélectif et pourraient potentiellement être biodégradables. C’est déjà le cas des cristaux produits et commercialisés à partir de Bacillus. Par ailleurs, les procédés de fabrication des pesticides microbiens génèrent moins de pollution. Enfin, cette stratégie permettrait d’exploiter les possibilités offertes par les manipulations génétiques (Glare et al. Reference Glare, Caradus, Gelernter, Jackson, Keyhani and Köhl2012). La surexpression de composés insecticides délivrés seuls dans l’environnement permettrait en effet une efficacité accrue du produit tout en évitant le rejet d’organismes génétiquement modifiés.
Les champignons entomopathogènes semblent particulièrement indiqués par la diversité des molécules qu’ils produisent. En effet, les métabolites extracellulaires sécrétés au cours de la croissance de certaines souches pourraient être valorisés sous forme de pesticides microbiens. Par rapport aux spores, ils présentent l’avantage d’être plus rapides (action en dedans de quelques heures) et moins dépendants des conditions de l’environnement (Butt et Copping Reference Butt and Copping2000; Srivastava et al. Reference Srivastava, Maurya, Sharma and Mohan2009). Ainsi, Mishra et al. (Reference Mishra, Keller, Miller, Heisey, Nair and Putnam1987) ont démontré les propriétés insecticides des métabolites de sept espèces de champignons sur des larves d’Aedes aegypti. Peu après, Vijayan et Balaraman (Reference Vijayan and Balaraman1991) ont testé les métabolites de 350 champignons et ont montré l’effet larvicide de 133 d’entre eux envers des larves de Culex quinquefasciatus, Anopheles stephensi et Aedes aegypti. De la même façon, l’effet insecticide des métabolites secondaires contenus dans les filtrats de cultures de nombreuses souches entomopathogènes a été montré par la suite (Priyanka et Prakash Reference Priyanka and Prakash2003; Govindarajan et al. Reference Govindarajan, Jebanesan and Reetha2005; Vyas et al. Reference Vyas, Dua and Prakash2007; Mohanty et al. Reference Mohanty, Raghavendra, Mittal and Dash2008; Mohanty et Prakash Reference Mohanty and Prakash2009; Murugesan et al. Reference Murugesan, Sathesh Prabu and Selvakumar2009; Singh et Prakash Reference Singh and Prakash2011, Reference Singh and Prakash2012). De nombreux champignons entomopathogènes peuvent potentiellement être cultivés dans des bioréacteurs et les composés insecticides résultant peuvent être entreposés, purifiés, conditionnés et utilisés contre des insectes nuisibles ciblés dans le cadre d’une gestion durable de ceux-ci (Copping et Menn Reference Copping and Menn2000). Cependant, le développement de procédés de production en bioréacteur efficaces et peu coûteux est un enjeu impératif. D’une part, les composants nutritionnels ont un impact sur l’activité insecticide des filtrats de culture (Mohanty et al. Reference Mohanty, Raghavendra, Mittal and Dash2008; Quesada-Moraga et Vey Reference Quesada-Moraga and Vey2011) et les substrats les plus adéquats doivent être déterminés. À cet effet, l’évaluation de milieux de culture non-synthétiques à base de sous-produits agricoles (disponibles en quantité par le biais de chaînes de production déjà existantes et peu coûteux) pourrait dégager des perspectives intéressantes (Dorta et al. Reference Dorta, Bosch, Arcas and Ertola1990; Sahayaraj et Namasivayam Reference Sahayaraj and Namasivayam2008). D’autre part se pose le choix du bioréacteur, avec ses avantages mais aussi ses contraintes techniques, et qui va influer également sur le type de métabolites produits par les champignons au cours du processus de fermentation (Assamoi et al. Reference Assamoi, Destain and Thonart2009).
Contexte d’urgence sanitaire
Une gestion intégrée des populations de moustiques implique tant que possible l’emploi de méthodes alternatives aux insecticides chimiques en se basant notamment sur les moyens physiques, les produits larvicides et l’éducation des populations concernées. Cette lutte préventive est essentielle pour faire face aux risques liés aux maladies infectieuses telles la dengue, le chikungunya ou encore le paludisme. Cependant, l’utilisation d’insecticides chimiques demeure nécessaire dans un contexte d’urgence sanitaire comme une épidémie (Protopopoff et al. Reference Protopopoff, Van Herp, Maes, Reid, Baza and D’Alessandro2007) ou l’éradication d’un vecteur invasif (Paupy et al. Reference Paupy, Delatte, Bagny, Corbel and Fontenille2009, Boukraa et al. Reference Boukraa, Raharimalala, Zimmer, Schaffner, Bawin, Haubruge and Francis2013) compte tenu des moyens de lutte actuels disponibles. Ceci se justifie par leur efficacité et leur rapidité d’action en dépit des impacts environnementaux.
La surveillance (1) épidémiologique des maladies à transmission vectorielle et (2) entomologique des espèces vectrices est un prérequis essentiel à tout plan de gestion de celles-ci. Le recensement et la signalisation des cas suspects (et pas seulement confirmés) est nécessaire dans une optique de prévention. Il est en effet primordial d’intervenir à ce stade par le renforcement des moyens de protection personnelle (répulsifs, moustiquaires imprégnés) et l’emploi de produits insecticides (Centre National d’Expertise sur les Vecteurs 2012; Organisation mondiale de la Santé 2012). Un exemple récent de programme de gestion peut être donné par la résurgence de la dengue (2004) puis du chikungunya (2006) sur l’île de la Réunion, se focalisant notamment sur le vecteur Aedes albopictus (Delatte et al. Reference Delatte, Paupy, Dehecq, Thiria, Failloux and Fontenille2008).
La pulvérisation d’adulticides (notamment pyréthrinoïdes) contre les stades imaginaux des vecteurs est essentiellement réservée aux contextes d’urgence sanitaire; elle permet de diminuer immédiatement les populations de moustiques adultes autour des cas de maladie (ou d’invasion) suspectés et/ou confirmés pour limiter le contact hôte/vecteur (Centre National d’Expertise sur les Vecteurs 2012; Organisation mondiale de la Santé 2012). Toutefois, cette pratique n’est efficace qu’à court terme car elle ne permet pas d’en atteindre la source. Le traitement des gîtes larvaires anthropiques (sans enjeu environnemental) et non suppressibles (vide sanitaire, fosse septique ou encore égouts) permet la destruction des milieux favorables au développement des stades immatures en milieu urbain (Centre National d’Expertise sur les Vecteurs 2012; Organisation mondiale de la Santé 2012). Cependant, l’apparition de résistances suite aux pressions de sélection exercées par les traitements successifs dans le cas d’épidémies répétées souligne l’importance des rotations et de la synergie des composés larvicides utilisés (Centre National d’Expertise sur les Vecteurs 2012). La résistance d’Aedes albopictus à de nombreux organophosphorés, pyréthrinoïdes et carbamates a par exemple été démontrée au Pakistan (Khan et al. Reference Khan, Akram, Shehzad and Shaalan2011). À nouveau, les préparations commerciales de Bacillus demeurent le seul moyen de lutte biologique susceptible d’être utilisé dans un contexte d’urgence sanitaire.
La mise en place d’une logique de lutte intégrée constitue donc le garant de l’efficacité des plans de gestion sur le long terme en évitant l’apparition de résistances à ces insecticides chimiques. Le développement de nouveaux composés est primordial pour limiter tant que possible l’emploi de ces insecticides et, finalement, les remplacer.
Conclusions
Les problèmes générés ces dernières décennies par l’utilisation massive d’insecticides chimiques ont stimulé l’intérêt populaire pour une gestion intégrée des populations d’insectes vecteurs de maladies, dont les moustiques. Parmi les différentes méthodes de lutte envisageables, les micro-organismes entomopathogènes (bactéries, virus, champignons) offrent une multitude de possibilités sous forme de biopesticides. Cependant, leur utilisation en lutte anti-vectorielle demeure encore limitée aux seuls cristaux de Bacillus. Afin d’intégrer plus efficacement les programmes de gestion, une virulence accrue des souches microbiennes ainsi que des procédés de production et de conditionnement plus rentables sont nécessaires. Dans cette optique, la valorisation de composés toxiques microbiens en tant que biopesticides à part entière pourrait permettre de dégager des perspectives intéressantes afin de pallier à ces inconvénients.











